外泌体miRNAs在监测癌症发展、疾病缓解和治疗效果和作为预后关键生物标志物中具有相当大的潜力,然而传统的miRNA检测技术受限于分辨率低,难以完成临床检测中的体液中低浓度或低样本量的外泌体miRNA检测。来自美国伊利诺伊大学香槟分校的研究人员报道了一种高效的目标循环放大过程(TRAP),通过光子共振吸收显微镜进行miRNA的数字检测,在20分钟内实现亚原子摩尔灵敏度的外泌体miRNA检测。TRAP方法是外泌体或循环miRNA生物标志物定量的理想方法,具有频繁、低成本和微创即时检测的潜力。相关研究以“Label-Free Identification of Exosomes using Raman Spectroscopy and Machine Learning”为题发表于1月9日的国际顶级化学期刊Angewandte Chemie International Edition杂志上。
外泌体microRNAs (miRNAs)被装载在细胞外囊泡中,在细胞间通讯、细胞增殖和炎症反应等生物过程中发挥着多种作用。miRNAs参与基因表达的转录后调控,因此,从外泌体释放miRNA可导致心血管疾病和癌症的发展。外泌体miRNAs被认为是诊断癌症发展和监测疾病进展、预测和确定治疗结果的关键生物标志物。然而,外泌体miRNA可能以极低的浓度存在于体内,这是目前利用外泌体miRNA作为生物标志物检测的障碍。例如,对于从细胞或血浆中分离出来的外泌体,即使是最丰富的miRNA序列(六种外泌体来源的某个分子含量平均为0.00825±0.02 /单一外泌体),平均每个外泌体中的miRNA数量也少于1个。
传统的miRNA定量是通过逆转录聚合酶链反应(qRT-PCR)等方法,被认为是miRNA定量的金标准,检测限为皮摩尔级。然而,qRT-PCR需要复杂的酶扩增和引物设计。其他定量方法包括:在细胞裂解物上进行的Northern blots和寡核苷酸微阵列;构建荧光报告细胞获得增强的荧光信号,用于分析细胞中的miRNA。传统的miRNA检测方法已不能满足当前的外泌体检测需求。环介导等温扩增(LAMP)、链位移扩增(SDA)、指数扩增反应(EXPAR)、滚动圈扩增(RCA)和一些无酶扩增方法,如催化发夹聚合(CHA)、杂交链式反应(HCR)和熵驱动催化等已被广泛应用于miRNA的高灵敏度检测。由于检测限和选择性的限制,这些方法在没有酶促靶标扩增的情况下,都没有被临床用于外泌体miRNA检测。因此,开发一种超灵敏和高选择性的诊断方法来有效检测和量化外泌体miRNAs的需求尚未得到满足。
研究团队开发了一种称为光子共振吸收显微镜(PRAM)的技术,可以通过共振耦合在光子晶体(PC)表面上可视化单个金纳米颗粒(AuNPs)标签。PRAM的检测原理是利用波长λ = 625 nm的共振PC反射,从相同波长的准直低强度LED照明中提供高反射强度到网络摄像头类型的图像传感器。AuNP在这里提供了强吸收特性,通过在同一波长下的局域表面等离子体共振。因此,与周围没有AuNP的区域相比,每个表面结合的AuNP在PC反射图像中表现为强度降低的位置。通过将目标激活的AuNP探针固定在PC表面,PRAM可以在单颗粒分辨率下定量核酸和蛋白质。团队此前的工作主要集中在检测化学合成的miRNA,其中每个检测到的miRNA分子与一个AuNP标签相关联,并且缺乏可以进一步降低检测限的扩增机制,因为目标miRNA分子被检测过程所消耗。
为了解决这一问题,研究人员采用了DNA驱动的分子机器,包括一系列脚点介导的DNA链置换反应(SDR),涉及目标回收作为构建可切换纳米器件、控制的纳米颗粒组装、介导的基因表达和程序化DNA计算的通用工具。在这项工作中,研究人员将miRNA检测限从皮摩尔级大幅降低(> 400倍)到亚原子摩尔浓度(0.24 aM),同时使用PRAM检测结合DNA燃料分子机器的目标回收将miRNA检测时间减少到20分钟。与传统的qRT-PCR相比,TRAP在分析肿瘤细胞来源的外泌体miRNA时表现出相似的准确性,但在miRNA-375和miRNA-21的检测限上分别表现出至少31倍和61倍的增强。这种检测方法只需一步、室温、一锅反应,只需要廉价的合成核酸,而且检测单个样本的成本不到5美元。TRAP方法还具有多通道重复检测能力,对样品体积的要求非常低(< 20 μL),具有广泛的应用前景。
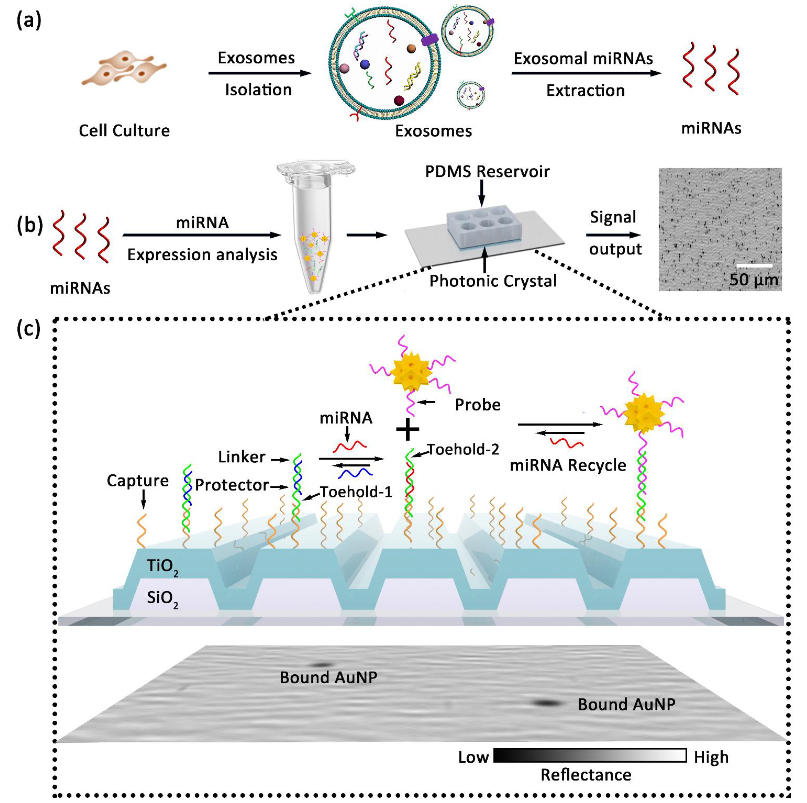
图:miRNA检测工作流程示意图。(a)提取的外泌体miRNAs与连接AuNPs的探针一起放置在应用于PC表面的PDMS库中。(b) TRAP用于PC生物传感器表面上的miRNA的数字分辨率检测,其中目标miRNA置换PC固定捕获分子上的保护链,通过链置换反应揭示连接子序列。(c) DNA连接器与部分互补保护器预退火,并与DNA捕获器杂交。在靶miRNA存在的情况下,连接器保护器通过置换保护器被“激活”,从而暴露出额外的DNA连接器序列。接下来,连接到AuNP的探针序列将miRNA靶标从捕获分子中移出,同时将AuNP与PC表面结合,从而释放miRNA并使其可用于另一个反应。通过AuNP的LSPR与PC共振之间的协同耦合,PC捕获的AuNP在单粒子分辨率下具有高对比度。
参考文献:A Target Recycling Amplification Process for the Digital Detection of Exosomal MicroRNAs through Photonic Resonator Absorption Microscopy. Angew Chem Int Ed Engl. 2023 Jan 9. doi: 10.1002/anie.202217932.
外泌体资讯网 Angew Chem Int Ed Engl丨通过光子共振吸收显微镜对外泌体miRNA进行信号放大和检测的技术