细胞外囊泡(EV)和纳米颗粒(NPs)的研究正在迅速增加,近年来人们揭示了囊泡比以前更多的复杂性和多样性,因此,我们对EVs和NPs释放所促进的细胞生物学和细胞间通信的理解一直处于不断变化的状态。来自美国范德堡大学医学中心的Robert J. Coffey课题组的研究人员发表综述,描述了不同类型的EV和NPs,重点介绍了最近的研究进展,并提出了主要的悬而未决的问题。相关内容以“Extracellular vesicles and nanoparticles: emerging complexities”为题发表于2月1日的国际顶级化学期刊Trends in Cell Biology杂志上。
细胞通过分泌信号分子相互交流,包括蛋白质、脂质和核酸。细胞可以将这些信号分子包装在EV中,以避免信号分子快速降解和免疫清除,从而实现细胞间的局部和远距离通信。EV是脂双分子层膜包裹的囊泡,由迄今为止在正常和病理条件下研究的所有类型的细胞释放,在所有组织和体液中都能检测到。人们目前已经鉴定出越来越多的EV类型。
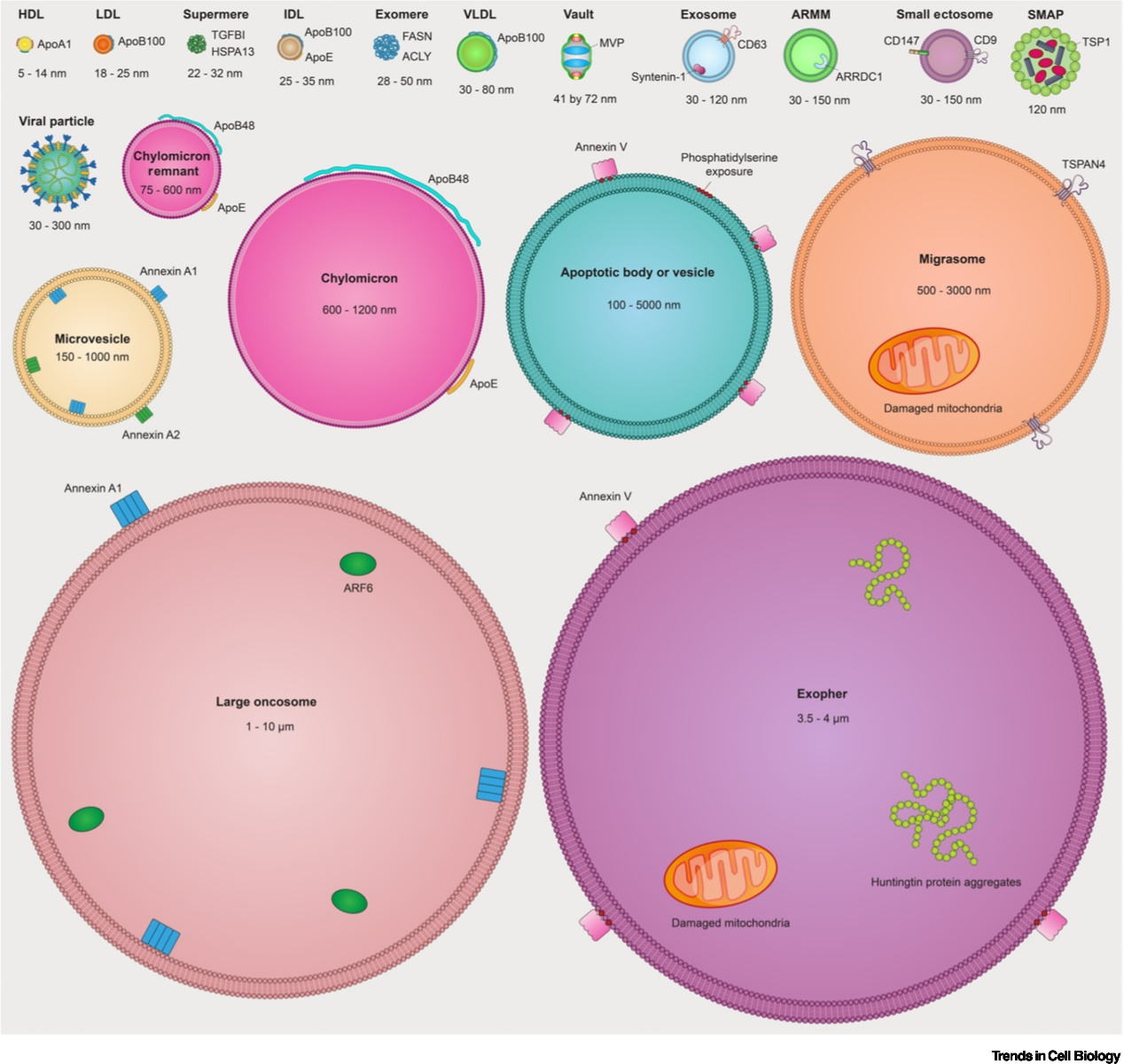
越来越多的人认识到,缺乏脂质双分子层膜的非囊泡性细胞外纳米颗粒 (NVEPs)存在于细胞外空间和体液中,且往往大量存在。NVEP不仅包括众所周知的实体,如脂蛋白颗粒等,还包括最近发现的exomeres和supermeres。EV和NVEP的发现主要是由于技术和方法的改进,以及对其复杂性和异质性的日益认识。
EV最初被怀疑是正常细胞处理不需要的物质以维持正常组织稳态的一种手段,或癌细胞促进肿瘤进展和转移的一种手段。然而,现在已经确定EV在细胞间通信中有许多作用,通过摄取EV货物后将其转移到受体细胞,或通过EV表面蛋白与细胞受体的相互作用来促进。通过EV介导的细胞-细胞通信对维持正常生理功能很重要,EV的异常信号传导也与许多疾病状态有关,包括癌症、心血管疾病、神经和免疫疾病。EV及其伴随的蛋白质、脂质和核酸(包括miRNA)是潜在生物标志物和治疗靶点的丰富来源,EV正被探索作为药物传递的载体。
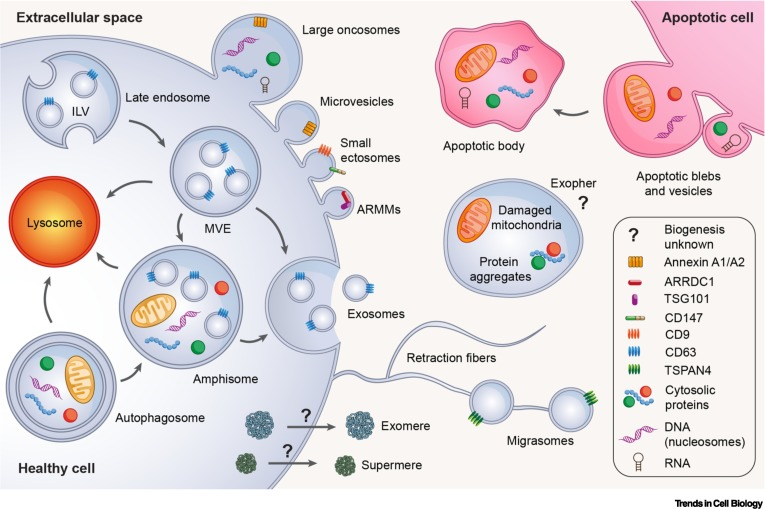
不同类型的EV已根据其起源和生物成因进行分类。有三种主要的EV生物发生模式是已知的:凋亡EV(称为凋亡小体和小泡)是由细胞凋亡的分裂产生的;ectosomes是由质膜直接向外出芽产生的;外泌体是由内体区室向内出芽产生的,后与质膜融合释放。为了应对过多的EV类型及其生物起源的许多实例的不确定性, MISEV采取了一种实用的方法,将EV分类为“大型EV”(>200 nm)或“小型EV”(<200 nm)。因此,研究人员综述了不同类型的EV和NVEP以及与这些细胞外颗粒相关的最新进展。
研究人员认为,尽管近年来关于EV的论文激增,细胞外NPs的论文预计也会增加,但更多的问题出现了。越来越清楚的是,细胞利用大量的EV和NVEP来促进与邻近和远处细胞的通信。但目前尚不清楚的是,如何有效地分离、分析和描述这种丰富的细胞间通信新媒介。关于EV和NVEP的研究结果取决于工作如何进行的细节,因为分离方案上的微小差异可能导致结果和结论的重大变化。然而,人们普遍认为EV代表了不同种类的囊泡。许多类型的EV,无论大小,都是由质膜直接出芽产生的,这些EV携带了许多以前被认为主要在外泌体中分泌的蛋白质。
研究人员强调,NVEPs,包括supermere、exomeres、vaults、脂蛋白、蛋白质组合,包括核糖体和核糖核蛋白复合物,可能负责大部分RNA的细胞外运输。如上所述,supermere和exomeres的生物成因是未知的,决定RNA或DNA如何以及为什么被包装在EV或NVEP中的机制在很大程度上也未被探索。目前还不清楚NVEPs的进一步异质性,也不清楚supermere和exomeres的一些成分是否可归因于其他不同的NPs,如核糖体或核糖核蛋白复合物。这些都是备受争议的话题,毫无疑问将成为未来几年激烈研究的焦点。
最后,研究人员展望,EV和蛋白质、脂质、RNA和DNA的其他细胞外载体的多样性,具有促进细胞间通信的潜力,在很大程度上依赖于用于分离和表征的方法和技术的发展。这一趋势很可能会持续下去。EV和NVEP研究的技术发展仍然是一个相对年轻但蓬勃发展的领域的主要研究和商业重点。虽然已经进行了大量的研究来阐明EV在细胞-细胞通信中的作用,但NVEPs在细胞间通信中的作用相对尚未探索。另一个主要挑战将是,如何将我们对特定细胞所拥有的大量EV和NVEP的理解,转化为完整生物体内如何促进通信的理解。
参考文献:Extracellular vesicles and nanoparticles: emerging complexities. Trends Cell Biol. 2023 Feb 1:S0962-8924(23)00005-3.