近年来,基于纸基核酸传感器已被证明能够检测从病毒和细菌中提取的DNA和RNA分子。在临床样本中,这些核酸大多包裹在脂膜中,在使用纸基传感器进行分析之前需要核酸的释放。对于核酸扩增试验(NAATs),同时需要去除能抑制核酸扩增的干扰分子。为了实现实时的NAAT,来自的研究人员美国爱荷华州立大学Meng Lu课题组的研究人员报告了一种便携式传感器系统,该系统结合了热分解和基于纸基的NAAT,以检测病毒和外泌体纳米颗粒携带的目标RNA分子。相关内容以“Integration of on-chip lysis and paper-based sensor for rapid detection of viral and exosomal RNAs”为题于2月6日在线发表在Biosensors & Bioelectron杂志上。
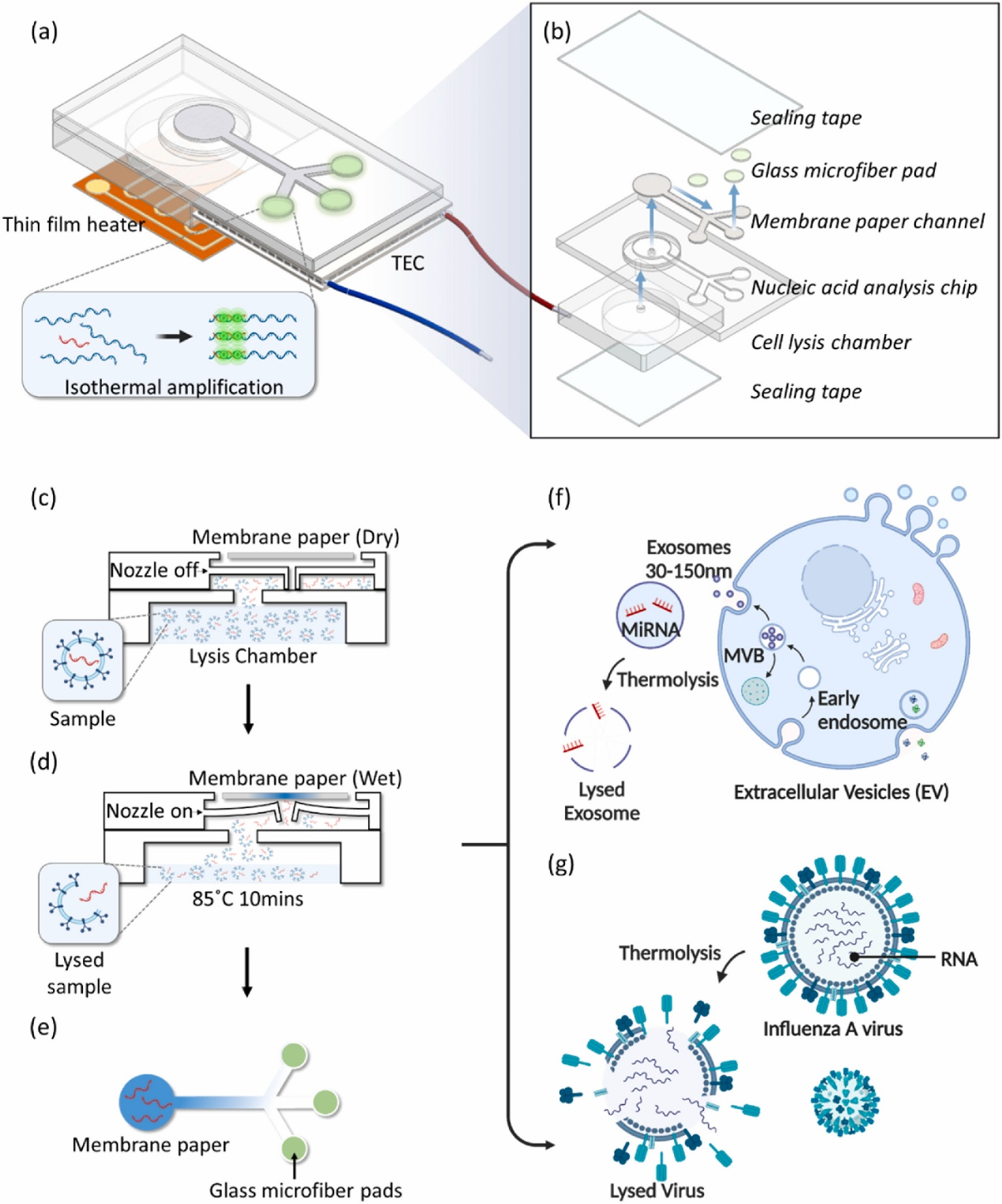
图:传感器示意图。该传感器包括一个带压力控制隔膜阀的裂解室、纸基流动通道和三个纸基NAAT反应室,分别用于提取、运输和检测核酸。整个系统可以完成紧凑的自动化的分析,收集核酸扩增的荧光图像,并生成扩增曲线的NAATs,能够在在1 h内实现了甲型流感病毒RNA和外泌体microRNA的定量分析。
在资源有限的环境中,纸基传感器被广泛用于疾病诊断的即时检测(POCT)。纸基POCTs的优点包括但不限于使用方便,由于是一次性传感器,价格低廉,能够将试剂存储在纸上,并且集成了样品加载、运输和分离步骤,可以快速返回测试结果。后来,建立在试纸上的横向流动分析(LFA)已经成功地用于检测各种分析物,如抗原和药物化合物。LFA最著名的应用是在尿样中检测人类绒毛膜促性腺激素的家庭妊娠试验。最近,在COVID-19大流行期间,新冠感染的快速家庭检测试纸主要依靠LFA传感器检测SARS-CoV-2抗原。
与具有设计良好的泵、混合器和阀门的微流控技术实现的微型全分析系统相比,基于纸基的传感器处理样品的能力仍然有限。例如,利用纸基传感器检测微纳米生物携带的核酸是一项挑战,因为核酸包裹在脂质膜中。在实现基于纸的传感器以量化目标DNA或RNA之前,需要上游裂解和核酸提取过程。虽然一些研究表明,裂解步骤可以与核酸扩增试验(NAATs)相结合,如定量聚合酶链式反应(qPCR)或环介导等温扩增(LAMP)方法检测SARS-CoV-2病毒,但其中的干扰因子会导致检测结果差异较大。因此,在定量分析前,裂解脂膜、从细胞或病毒中释放核酸是必需的。
常见的裂解方法包括热裂解、化学裂解、溶菌酶裂解或机械裂解,这些方法都可以破坏脂膜。化学和酶处理很简单,但需要额外的步骤来提取核酸,并去除干扰下游NAAT的化学物质。机械破坏裂解过程需要均质器,不适合POCT应用。相比之下,热裂解能够通过简单的加热过程裂解细胞和病毒纳米颗粒,而不引入潜在的PCR抑制剂。在基于纸基的POCT系统中,使用热解法可以显著简化脂膜包裹的RNA的检测,实现定量分析,并提供更好的重复性。
研究人员报道了一种无泵核酸提取和基于纸基传感器的集成装置,用于检测包裹在脂质纳米颗粒中的RNA,如病毒和外泌体来源。如示意图所示,传感器盒包括一个带压力控制隔膜阀的热解室、一个纸流体通道和三个基于纸基的反应垫——用于存储分析试剂。用户只需要将样品装入热解室,Arduino微芯片管理两个加热器,并获取荧光图像来执行整个分析。在测试过程中,热解室中的样品被加热以释放核酸,并通过隔膜中心的喷嘴蒸发。样品蒸气随后由纸条收集并转移到反应垫,用于检测目标核酸。采用LAMP和指数扩增反应(EXPAR)两种等温扩增方法分别检测甲型流感病毒(IAV)中的RNA和巨噬细胞源性外泌体携带的microRNA。结果显示,该无泵和纸基传感器在1 h内实现了IAV的RNA和外泌体microRNA的定量分析,IAV和外泌体的最低检测浓度分别为104 TCID50/mL和106 EV/mL。该系统具有存储方便、操作简单、成本低等优点,可作为实时检测病毒和细菌感染的检测手段。
参考文献:Integration of on-chip lysis and paper-based sensor for rapid detection of viral and exosomal RNAs. Biosens Bioelectron. 2023 Feb 1;226:115114.