细胞外囊泡(EVs)与心血管疾病和癌症的发生和发展密切相关,在液体活检中潜力巨大。
近日,来自上海大学生命科学学院赵婧团队的研究者建立了一种基于磷脂酰丝氨酸多肽配体识别EVs脂质的通用平台,满足“多功能”的EVs分析需求,并通过电化学传感方法实现量化心肌梗死患者血液样本中的CD172a阳性EV与乳腺癌患者血液样本中的PD-L1阳性EV,证明了循环EVs在这些疾病的诊断中具有更好的预后价值。该成果已以“A versatile design-enabled analysis of circulating extracellular vesicles in disease diagnosis”为题发表在Advanced Healthcare Materials(IF=11.092)上 (2023 Feb 5;e2203119)。上海大学硕士研究生刘琪和上海第十人民医院医生姚建华为论文共同第一作者,上海大学曹亚副教授,贝毅桦副教授和赵婧教授为文章共同通讯作者。
细胞外囊泡(EVs)由细胞内运输途径产生,携带来源于原始细胞的多种成分,包括DNA、RNA、脂质和蛋白质。分泌细胞的EVs参与细胞通讯、分化和发育有关的多种生理过程。此外,在一些病理过程中也发现了EVs的参与。越来越多的报告显示,与健康人相比,某些疾病患者的EVs表面蛋白表达水平有差异。因此,基于EVs的分析正被用于癌症、心血管疾病和其他疾病的早期检测。目前,EVs分析依赖于EVs表面蛋白的识别,例如CD63、CD9和CD81。然而,因为EVs的蛋白质表达水平可能随细胞的表型和来源而变化,所以这种分析不适用于表面蛋白表达水平较低的EVs,不能满足对循环EVs的高灵敏检测和分析的多重需求。
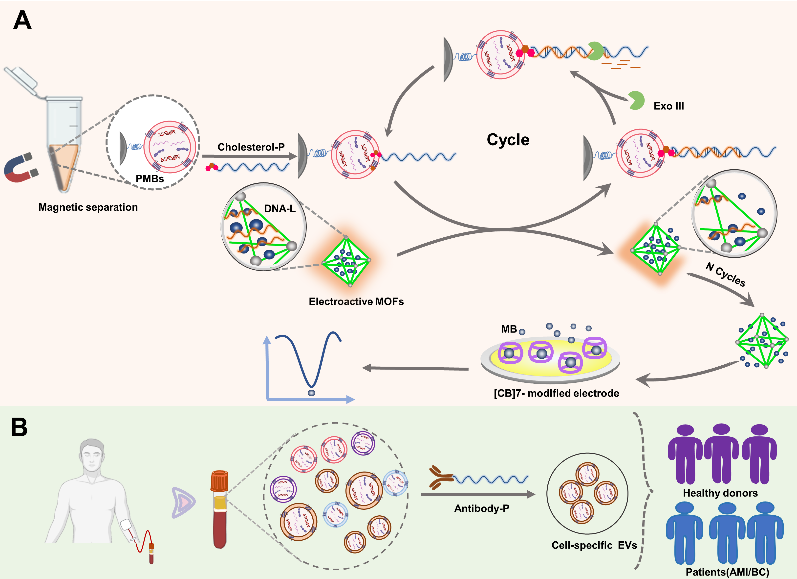
为了解决这一问题,研究团队开发了一种基于磷脂酰丝氨酸多肽配体识别EVs脂质的通用平台,结合具有高负载能力的多孔纳米材料金属有机框架(MOF),满足“多功能”的EVs分析需求。越来越多的研究表明,在细胞外囊泡形成期间,位于正常质膜内小叶的磷脂酰丝氨酸会在EVs膜外化,参与EVs介导的细胞内通讯,成为EVs特异性脂质生物标志物。在这项工作中,磷脂酰丝氨酸多肽配体功能化磁珠保证了EVs的充分富集,几乎不受EVs表面蛋白表达差异的影响。研究人员将电信号亚甲基蓝封装到MOF中,并随后引入DNA-L,其能通过Zr-O-P键与MOF结合,对MOF表面进行包裹,形成能够作为电化学信号守门员的DNA门控金属有机框架。胆固醇修饰的DNA探针P(cholesterol-P)能够通过疏水性相互作用插入细胞外囊泡的膜表面, 其能够与DNA门控的金属有机框架保护性屏障DNA-L互补从而使DNA-L脱落,加入的核酸外切酶III能够加速该过程,释放大量亚甲蓝分子放大电化学信号,实现了电化学方法对细胞外囊泡进行定量(图A)。
有趣的是,与EVs膜结合的DNA探针是可调节的,能够满足EV分析的不同需求,胆固醇修饰的DNA探针(cholesterol-P)用于非特异性总EVs的
通用分析,而抗体-DNA探针则能够用于分析特异性的EVs。抗体功能化的DNA-P(antibody-P)能够通过抗原抗体的相互作用识别细胞外囊泡的表面特异性蛋白标志物,与DNA门控的金属有机框架保护性屏障DNA-L互补从而使DNA-L脱落,释放亚甲基蓝电化学信号。为了证明该设计在特异性EVs中检测的可行性,研究团队使用该方法分析癌细胞和心肌细胞中分离的EVs,心肌细胞EVs定量检测的灵敏度低至704 particles/mL。在心血管疾病患者和乳腺癌患者的临床分析中,与对照组相比,在未稀释的心血管患者以及乳腺癌患者的血清样品中发现循环的CD172a+和PD-L1+ EVs水平升高,表明特异性循环EVs水平与疾病进展呈正相关。该设计在复杂环境中的应用也有很好的可行性和稳定性,满足多种疾病临床诊断的多重需求。(图B)
多功能分析循环细胞外囊泡的示意图。(A)总循环细胞外囊泡的定量分析。(B) 特异性探针用于特异性循环细胞外囊泡分析。
参考文献:
A versatile design-enabled analysis of circulating extracellular vesicles in disease diagnosis. Advanced Healthcare Materials. DOI: 10.1002/adhm.202203119.
外泌体资讯网 ADV HEALTHC MATER | 上海大学生命科学学院赵婧团队: 一种多功能设计,可用于疾病诊断中循环细胞外囊泡的分析技术