雌激素受体α(ERα)失调与代谢和心血管疾病风险增加有关。近日,发表在Nature Cardiovascular Research杂志上的一篇报道通过生成并表征心肌细胞ERα特异性敲除(ERα HKO)小鼠,以评估ERα在心脏中的作用。最引人注目的表型是雌性ERα HKO小鼠肥胖,而雄性ERα HKO小鼠不会。雌性ERα HKO小鼠表现出心脏功能障碍、轻度葡萄糖和胰岛素不耐受以及骨骼肌和白色脂肪组织中ERα基因表达降低。
拉筹伯大学和贝克心脏与糖尿病研究所的研究人员发现,心脏中雌激素受体α(ERα)的缺乏会导致雌性小鼠肥胖,这为绝经后妇女提供了重要见解。众所周知,雌激素在保护女性心脏方面发挥着重要作用,但一旦女性绝经后雌激素水平下降,她们患多种病症的风险就会增加,包括心脏病、肥胖症和糖尿病。该研究发现负责心脏收缩的细胞(心肌细胞)中ERα的减少会导致雌性小鼠中度心脏功能障碍和肥胖率增加,但雄性小鼠不会。
来自贝克心脏和糖尿病研究所的Julie McMullen教授说,研究小组在心脏中发现了一种性激素受体,可以调节女性的肥胖。
“一段时间以来,我们一直有兴趣尝试了解这种雌激素受体在心脏中的作用,看看它如何为心脏提供保护,”McMullen教授说。“当我们阻断这种雌激素受体时,我们预计会看到主要是心脏的变化和损伤。但我们看到的不是戏剧性的心脏表型,而是肥胖表型。所以,我们观察到雌性老鼠更重,脂肪量更多,这是我们完全没有预料到的。”
当ERα减少时,对心脏收缩力和心脏代谢功能很重要的基因在女性心脏中也较低,这解释了为什么女性心脏不能很好地泵血。拉筹伯大学细胞外囊泡生物学专家David Greening副教授说,从ERα减少的女性心脏释放的称为细胞外囊泡的颗粒含有与对照组和男性心脏不同的蛋白质。
“我们发现减少雌性小鼠心肌细胞(心肌细胞)中的 ERα 会导致心脏的转录、脂质组学和代谢失调,以及骨骼肌和脂肪组织的代谢失调,” David Greening副教授说。“此外,从ERα减少的心脏细胞释放的细胞外囊泡具有在细胞培养物中重新编程骨骼肌细胞的能力。组织、细胞外囊泡蛋白质组和重新编程的骨骼肌细胞的这些变化改变了细胞的分子特征和功能。因此,能量没有被消耗,而是被储存起来,这解释了在没有ERα的情况下雌性小鼠的肥胖增加,”Greening副教授说。
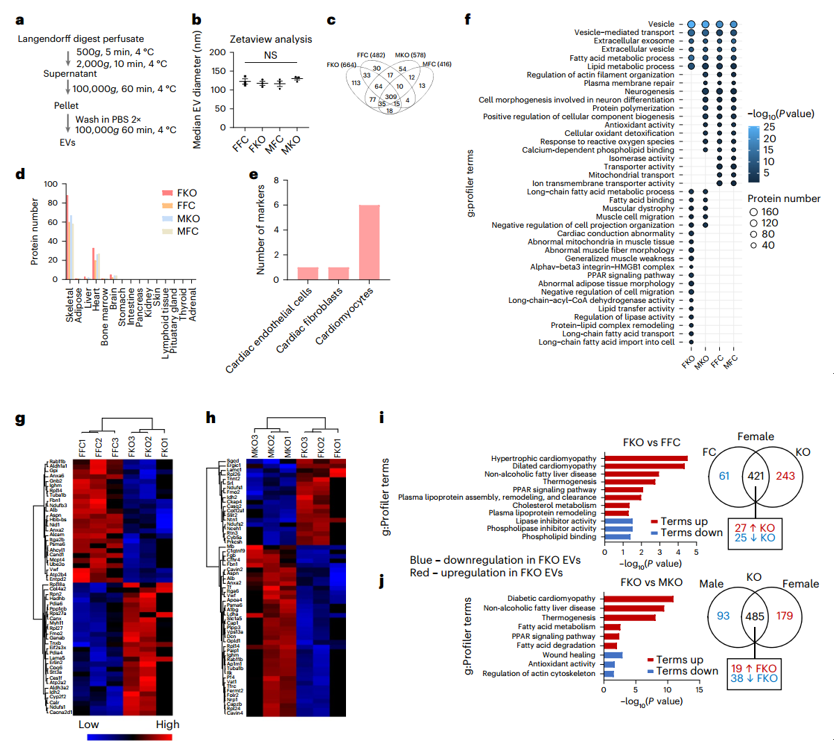
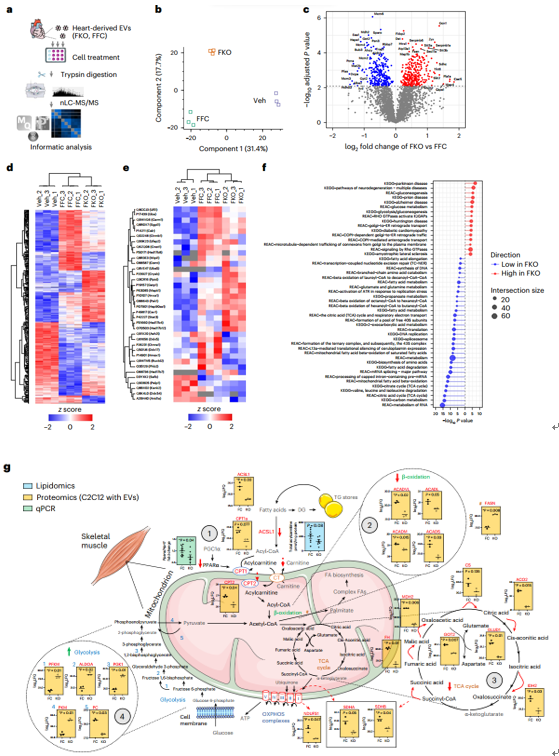
小鼠心脏细胞外囊泡的蛋白质组学分析
转录组学、蛋白质组学、脂质组学和代谢组学分析揭示了心脏、骨骼肌和白色脂肪组织收缩和/或代谢失调的证据。研究表明,来自雌性ERα HKO小鼠的心脏来源的细胞外囊泡含有与脂质和代谢调节相关的独特蛋白质组,并且具有代谢重编程目标骨骼肌细胞蛋白质组的能力,对糖酵解能力和储备具有功能性影响。
ERα HKO雌性心脏衍生的EV介导的细胞蛋白质组和C2C12肌管的功能重编程
这项重要工作对预防和治疗绝经后妇女的心脏和代谢疾病具有重要意义,而且对接受可能抑制或减少心脏 ERα 治疗的绝经前妇女的心脏毒性也有影响。
McMullen教授说:“服用可以与这种特定受体相互作用或抑制这种特定受体的药物(包括一些化学疗法)的女性通常会变得肥胖。”“现在我们对ERα有了更好的了解,我们就有更好的机会确定预防肥胖发生的疗法。”
Greening副教授说,这项研究表明,“细胞外囊泡——纳米囊泡及其包装的分子货物——是系统信号调节剂,可以传播并影响身体的其他器官,包括脂肪组织和骨骼肌”。“因此,细胞外囊泡为健康和疾病中细胞、组织和器官之间的串扰提供了一种新的范例,” Greening副教授说。这项多组学研究揭示了由ERα调节的心脏启动和性别特异性心脏代谢表型,并提供了对细胞外囊泡介导的器官间通讯的见解。
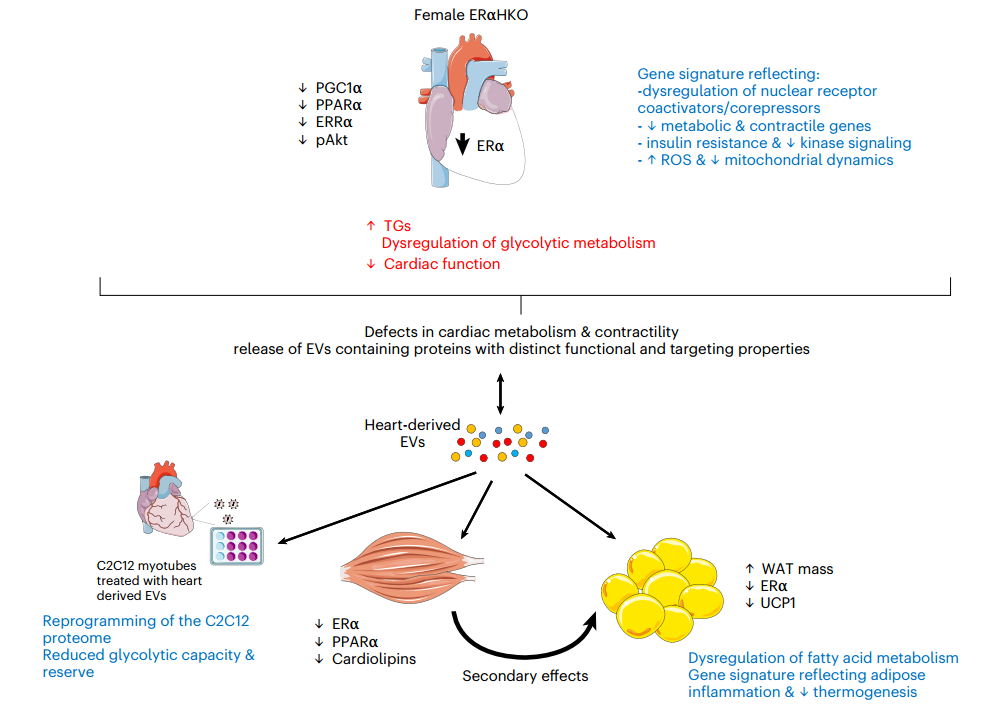
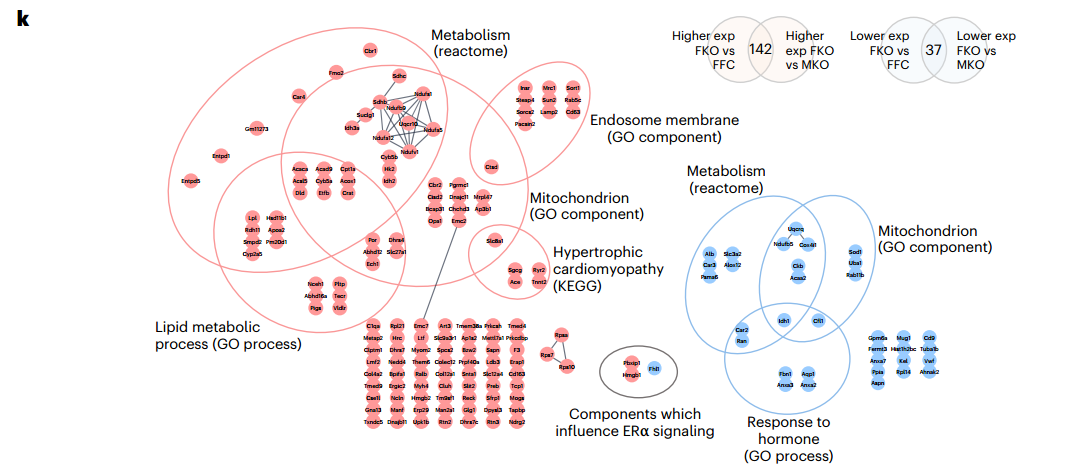
基于功能和多组学分析的雌性ERα HKO小鼠表型的发现和潜在机制总结
总之,这项工作提供了关于ERα在正常心脏生理学中的作用的额外知识,并确定了心脏引发的性别特异性代谢表型。研究表明,雌性小鼠心肌细胞中ERα的减少会导致心脏的转录、脂质组学和代谢失调,以及骨骼肌和WAT中的代谢失调。此外,该表型与具有重塑蛋白质组的心脏衍生EV相关,并且能够重新编程骨骼肌细胞的信号和蛋白质组特征,从而影响代谢编程和糖酵解功能。组织、EV蛋白质组和重新编程的骨骼肌细胞的集体代谢变化与从能量消耗到储存的转变一致,这可能导致雌性ERα HKO小鼠的肥胖增加。这项工作对预防和治疗绝经后妇女的心脏和代谢疾病有影响,而且对接受抑制/减少心脏ERα治疗的绝经前妇女的心脏毒性也有影响。
参考文献:
Tham, Y.K., Bernardo, B.C., Claridge, B. et al. Estrogen receptor alpha deficiency in cardiomyocytes reprograms the heart-derived extracellular vesicle proteome and induces obesity in female mice. Nat Cardiovasc Res (2023). DOI: 10.1038/s44161-023-00223-z