早期癌症的筛查具有重要的临床价值,但目前还没有一种方法可以全面识别多种早期癌症类型。来自韩国EXoPERT公司和高丽大学的研究人员展示了一种结合人工智能(AI)和表面增强拉曼光谱(SERS)的液体活检方法,使用520个未用于训练的测试样本,包括6种癌症类型(肺癌、乳腺癌、结肠癌、肝癌、胰腺癌和胃癌)和早期癌症患者,测试了该方法的诊断性能,并利用这种通过血浆外泌体的无标记分析同时实现多种癌症类型的诊断。相关内容以“Single test-based diagnosis of multiple cancer types using Exosome-SERS-AI for early stage cancers”为题于3月24日发表在国际学术期刊Nature Communications杂志上。
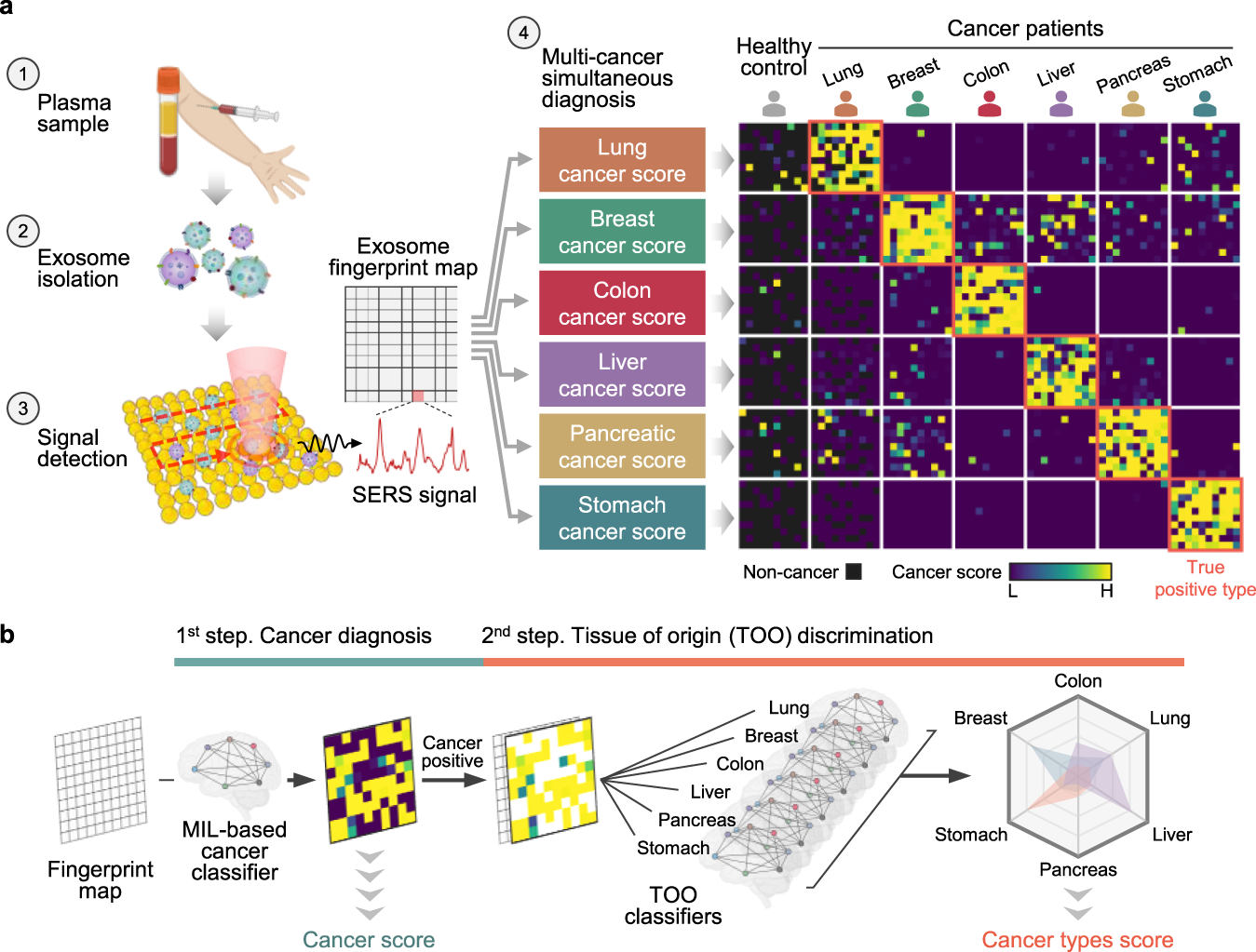
图:Exosome-SERS-AI系统的设计思路和检测方法。a. 外泌体悬浮液滴到金纳米颗粒聚集阵列芯片上并彻底干燥,在每个样本100个点(10 × 10)处观测信号,并采用人工智能算法进行分析。该系统输出了关于癌症存在和起源组织的预测。热图显示每种癌症状态的代表性预测结果的实际示例。b.人工智能框架。在第一步中,诊断分数被分配为基于多实例学习的癌症分类器结果的平均值。在第二步中,分析之前癌症分类器预测的信号,然后使用六种预测模型计算平均得分。
在现代社会,癌症仍然是导致因疾病死亡的主要原因,如果能实现早期诊断,通过提供及时和最佳的治疗,能够最大程度改善癌症的结果。因此,通过体外诊断检测早期癌症是生物医学领域的一个重要目标,可以实现常规癌症进程的管理。目前,几种癌症生物标志物,包括癌胚抗原(CEA)和前列腺特异性抗原(PSA),已被用于诊断和预后策略,但这些标志物很少出现在恶性肿瘤的早期阶段,因此无法通过这些标志物进行早期诊断。其他类型的癌症仍然没有有效的预筛查工具。最近,一些生物标志物,包括CTC、cfDNA、以及携带来自肿瘤细胞的细胞质和膜信息的细胞外囊泡(EV),已成为许多类型癌症的液体活检方法中有吸引力的生物医学靶点。
外泌体是纳米级小型EV的一种亚型,由脂质双分子层包裹,并由活细胞分泌,因此外泌体可用于非侵入性地获取癌细胞的信息。除了肿瘤细胞直接分泌外泌体外,各种生物因素,包括免疫调节、肿瘤微环境和血管生成,都与外泌体有关,并可能这些因素会导致血液中的外泌体成分出现差异。因此,如果外泌体的癌症相关特征模式在各种癌症类型之间得到区分,那么同时对多种癌症类型进行液体活检将是有可能的。
在这种情况下,获得化学结构振动和旋转模式信息的振动光谱技术正在成为识别不同类型生物样品的主要工具。特别是,拉曼光谱是一种检测生物材料(如外泌体)成分差异的强大方法,其优点是简单、无损、只需要较少的分析量。随着等离子体增强方法的发展,例如表面增强拉曼光谱(SERS),许多研究团队已经使用拉曼光谱分析了各种EVs的表型和特征。这些研究表明,从细胞培养介质到血液的各种生物样本中的EV和外泌体,可以在缺少表面标记物和无特异性抗原的情况下被识别。特别是,目前多元统计方法和包括人工智能(AI)在内的机器学习技术的进步,使得识别这些振动光谱更加精确和容易。
在这项研究中,研究人员报告了一项回顾性研究设计,通过使用人工智能分析外泌体的表面增强拉曼光谱(SERS)谱,同时检测6种早期癌症(肺癌、乳腺癌、结肠癌、肝癌、胰腺癌和胃癌)的诊断准确性。研究人员获取分离的外泌体的SERS信号,然后用深度学习模型对它们进行分析,从而实现癌症诊断和组织起源(TOO)的异质性分析。在第一步中,深度学习模型将每个信号分类为正常或癌症类性,得出癌症存在的分数。在第二步中,多个分类器模型使用one-vs-rest方法从第一步开始生成正预测的TOO判定结果。最终通过这些方法,研究人员识别了正常和癌症患者血浆外泌体信号模式的分类模型,并获得了它们的存在和起源组织。研究人员使用520个测试样本,得到的这个分析系统能识别出癌症的存在,曲线值下的面积为0.970。此外,该系统对278例早期癌症患者的肿瘤器官类型进行了分类,曲线下平均面积为0.945。最终的综合决策模型在预测72%阳性患者的肿瘤器官时,敏感性为90.2%,特异性为94.4%。由于这种的方法利用了拉曼信号的非特异性分析,因此其诊断范围可能会扩大到包括其他疾病类型中得到更多应用。
参考文献:Single test-based diagnosis of multiple cancer types using Exosome-SERS-AI for early stage cancers. Nat Commun. 2023 Mar 24;14(1):1644.