癌症恶病质是一种多因素综合征,其特征是骨骼肌的显著丢失,对生活质量产生负面影响。抑制肌肉生长和分化的负调节因子myostatin(Mstn)已被证明可以保留肌肉质量,包括恶病质等肌肉萎缩性疾病。然而,由于现有递送方法的效率和毒性较差,myostatin抑制剂在临床试验中反复失败。近日,新加坡国立大学的黎月明博士(Dr Minh Le)等在Mol Ther杂志发表文章,描述了一种使用红细胞外囊泡(RBCEVs)将Mstn siRNA递送到骨骼肌中的新方法,并在癌症恶病质小鼠模型中进行了功能验证。
癌症恶病质是一种多因素并发症,影响了约80%的晚期癌症患者。癌症恶病质的特征是持续的体重减轻和骨骼肌进行性萎缩。癌症恶病质的机制复杂且相互交织。原发肿瘤、转移或活化的免疫细胞分泌的各种炎性细胞因子和促恶病质因子参与肌肉分解并传递促萎缩信号,最终促进癌症恶病质。恶病质会导致患者虚弱,并常常因手术和化疗而加重。重要的是,它对生命的质量和寿命产生不利影响,因此在约20-30%的癌症患者中代表着死亡的主要原因。尽管癌症恶病质的患病率很高,但目前没有标准治愈方法。与临床医生普遍认为的相反,实验模型表明,恶病质并非完全不可逆转。然而,在实践中,传统的营养支持、食欲刺激剂和体育锻炼只能在部分恢复骨骼肌肌肉量方面产生轻微效果。
目前,由于缺乏安全有效的药物治疗,相当一部分的癌症患者仍然会死于消瘦症。事实上,由于效力不足和导致严重副作用的风险,许多新型治疗试验在临床开发的各个阶段都失败了。因此,癌症消瘦仍然是一个未被满足的医学需求。癌症消瘦的主要表现是骨骼肌质量和/或力量的非自愿丧失,并已在许多癌症类型中得到证明,包括黑色素瘤、胰腺、肝脏、肺和结直肠癌等。有趣的是,一系列的临床前证据表明,在癌症消瘦动物模型中逆转骨骼肌损失可以延长生存时间,尽管肿瘤负担仍在继续。逆转体重和肌肉质量的损失代表了消瘦的最终管理目标,为癌症患者提供了缓解症状和支持性护理。
Myostatin (MSTN)是转化生长因子-β(TGF-β)超家族的成员,高度表达于骨骼肌,作为骨骼肌生长和分化的负调节因子。抑制MSTN信号传导或MSTN基因的突变已被证明可以抵消肌肉质量和力量的丧失,并延长生存期,而不影响动物癌症恶病质模型中的肿瘤生长。目前已经付出了大量努力,开发能够调节MSTN信号的药物用于临床应用。然而,迄今为止在临床试验中测试的MSTN抑制剂仅限于蛋白质药物,例如中和抗体、peptibody、monobody或诱饵受体,与小分子化合物相比,这些药物可能会在生产上带来更高的复杂性和费用,从而给临床开发和应用带来困难。大多数MSTN抑制剂表现出不一致的功能益处、非肌肉相关的不良反应(包括毛细血管扩张和出血),更重要的是,由于MSTN靶向剂与其他TGF-β(或受体)家族成员之间的交叉反应,导致心脏和其他组织的非靶向效应,因此强调了需要高度特异性的药物和模式,只针对骨骼肌中的MSTN。此外,鉴于癌症恶病质和其他肌萎缩疾病的复杂发病机制,能够同时针对MSTN和其他基因进行特异性靶向的多靶点方法可能显示出更优越的治疗窗口。
过度脂肪分解在驱动骨骼肌萎缩中发挥重要作用。在癌症恶病质模型中,脂肪流失通常先于肌肉流失,并由于升高的脂解作用与过度的脂肪酸氧化而产生。药物阻断或基因抑制脂质分解可有效预防骨骼肌消耗。在脂肪酸生物合成和氧化中,马龙酰辅酶A脱羧酶(Mcd或Mlycd)是一个主要的调节因子,它催化马龙酰辅酶A的耗尽以产生乙酰辅酶A,从而通过缓解马龙酰辅酶A介导的肉毒碱棕榈酰转移酶抑制,特别是在骨骼肌中激活脂肪酸氧化。有趣的是,在癌症恶病质小鼠模型中,马龙酰辅酶A的数量与脂肪酸β-氧化成反比。因此,抑制马龙酰辅酶A脱羧酶基因(Mlycd)提供了一种替代治疗策略,可以快速且选择性地增加骨骼肌中的马龙酰辅酶A水平,从而减少癌症恶病质中过度的脂肪酸氧化和肌肉萎缩。
siRNA基因治疗是一种有前途的治疗方式,因为它以序列特异性的方式靶向与疾病相关的基因,从而实现更精确和个性化的治疗。然而,裸露未修饰的siRNA的细胞内外渗透性、活性和稳定性等问题阻碍了其广泛的临床应用。使用siRNA的最大限制在于需要实现对所需细胞和组织的高效和安全传递。为了克服这些障碍,已经广泛使用了一些传递系统,例如脂质体、阳离子聚合物和穿透细胞肽(CPPs)。然而,它们的安全性、毒性和特异性一直是一个令人担忧的问题。阳离子脂质体和聚合物往往会在多个器官中诱导DNA损伤并增加促炎基因表达。具有低组织选择性的CPP通过非特异性细胞内吞作用将载体输送到全身,导致由载体引起的意外毒性。
最近,由于其作为纳米载体的生物安全性和生物相容性,细胞外囊泡(EV)因临床应用而备受关注。EV是自然分泌的膜囊泡,包括外泌体和微囊泡。它们广泛分布于体液中,并通过运输生物活性核酸、蛋白质和脂质到相邻和远离的细胞中,在细胞间通讯中发挥着重要作用。由于其通过组织和细胞脂质膜屏障的内在能力,EV正成为新型和有前途的药物传递载体。就可及性、可扩展性、成本效益、非免疫原性和非致癌性而言,作者开发的红细胞衍生的细胞外囊泡(RBCEV)优于传统合成载体和其他来源的EV。作者最近开发了一种先进的RBC EV抗癌治疗药物传递平台。强调了RBCEV对各种荷载的多功能范围,从反义寡核苷酸(ASO)和免疫调节RNA(发夹环RNA)到亲水分子如紫杉醇。RBCEV传递的治疗荷载在近端和远端肿瘤细胞中均具有较高的倾向性,在功能上抑制了肿瘤生长和进展。此外,表面蛋白共价结合受体特异性肽/纳米抗体的RBCEV具有更高的肿瘤生物可用性,从而使药物剂量大大降低,从而提高了疗效和安全性。
该文研究了红细胞衍生的细胞外囊泡(RBCEVs)如何通过肌肉细胞内吞作用在体内和体外被肌肉细胞强烈吸收。研究人员将Mstn siRNA和Mlycd siRNA装载到RBCEVs中,通过肌肉内注射的方式,特异性地和高效地抑制了Mstn和Mlycd的表达,从而增加了野生型小鼠的骨骼肌生长。此外,Mstn siRNA和Mlycd siRNA装载的RBCEVs在癌症恶病质小鼠模型中缓解了骨骼肌损失并延长了存活率。最后,RBCEVs在治疗有效剂量下没有显示出系统毒性和炎症效应,为肌肉退化性疾病提供了一种安全而高效的siRNA药物递送策略。
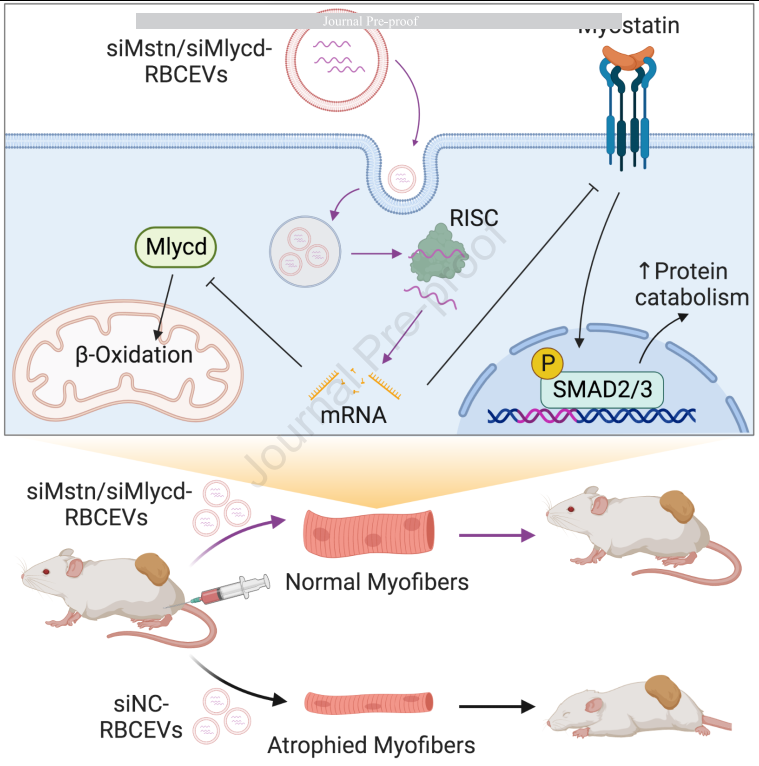
该研究数据表明,RBC EVs通过肌肉内注射被肌纤维吞噬。通过RBCEVs重复的肌肉内注射,siRNA被递送,从而抑制Mstn,增加肌肉生长并预防癌症患者的恶病质。当递送针对马来酰辅酶A脱羧酶的siRNA时,我们观察到相同的治疗效果,该酶在癌症恶病质期间驱动功能失调的脂肪酸代谢。该研究证明了RBCEVs通过肌肉内siRNA递送是安全且无炎性的。因此,这种方法有助于降低siRNA的治疗剂量,避免因高剂量裸siRNA的全身给药而引起毒性和非靶效应。
参考文献:
Peng B, Yang Y, Wu Z, Tan R, Pham TT, Meng Yeo EY, Pirisinu M, Jayasinghe MK, Chanh Pham T, Liang K, Shyh-Chang N, Le MT. Red blood cell extracellular vesicles deliver therapeutic siRNAs to skeletal muscles for treatment of cancer cachexia. Mol Ther. 2023 Apr 3:S1525-0016(23)00196-X. doi: 10.1016/j.ymthe.2023.03.036. PMID: 37016578.





