肝细胞癌是原发性肝癌的主要类型,也是全球癌症相关死亡的重要原因。肝癌前病变和早期肝癌患者可采用根治性疗法治疗。但是由于缺乏特定的早期症状和生物标志物,大多数患者通常在肿瘤不可切除的晚期被诊断出来,预后极差。虽然基于免疫调节的新的治疗方法显露出抗肝癌的优势,但只有约20%的患者有持续的应答。随着细胞外囊泡作为功能性通讯途径的特性被不断揭示,其在癌症诊断和治疗中的作用也逐渐显现出来。近日,上海中医药大学高月求及余卓教授团队在Front Mol Biosci杂志发表了题为“Advances of multi-omics applications in hepatic precancerous lesions and hepatocellular carcinoma: The role of extracellular vesicles”的综述(2023 Mar 16;10:1114594),概述了细胞外囊泡的多组学分析如何有助于识别新的候选生物标志物并讨论了以细胞外囊泡为中心的新型癌症免疫疗法。文章的第一作者为鲁晓娜博士研究生,通讯作者为高月求教授与余卓教授。
近年来,在发现细胞外囊泡(extracellular vesicles, EVs)可以作为蛋白质、核酸、脂质、代谢物等在细胞间转运的载体后,人们对EVs的兴趣急剧增加。EVs是由脂质双层分隔的颗粒,几乎可以从所有类型的细胞中自然释放出来,根据其生物合成或释放途径可大致分为三大类:外泌体(Exosome)、微囊泡(Microvesicles/microparticles/ectosomes)和凋亡小体(Apoptotic bodies)。在它们的生物发生过程中,EVs 选择性地富含一系列生物活性货物分子。虽然一些蛋白质可能在 EVs 亚型中共享,但囊泡货物高度依赖于供体细胞的类型和生理或病理状态。在肿瘤微环境中,EVs可以在肿瘤细胞、基质细胞和免疫细胞之间转移分子货物,进行细胞间通讯。研究证明了它在肿瘤进展和抗肿瘤免疫反应中发挥的关键作用。最近,多组学技术的发展和可用性,包括基因组学、转录组学、蛋白质组学、代谢组学和脂质组学等,使得对EVs的研究更加深入,这为发现新候选生物标志物和开发癌症治疗新策略提供了有用的见解。这篇文章通过多组学分析回顾了EVs在早期诊断中的作用以及EVs的免疫治疗潜力。EVs 存在于不同的生物体液中,携带来自亲本细胞的各种生物分子。从肿瘤细胞释放到血液中的EVs可以提供整个肿瘤的快照,代表了可以从血液样本中收集和分析的生物标志物目标,为癌症早期诊断提供了巨大的潜力。最近的研究表明,EVs中存在完整基因组DNA(gDNA)、线粒体 DNA(mtDNA) 甚至病毒 DNA,并且富含多种类型的 RNA货物,包括mRNA以及一些非编码RNA (ncRNA),例如microRNAs (miRNAs)、long non-coding RNAs (lncRNAs) 、circular RNAs (circRNAs)、transfer RNA (tRNA)。借助基因组学/转录组学技术对它们进行表征,揭示了许多有意义的HCC诊断标志物。蛋白质是生理和病理功能的执行者,与EVs密切相关,也是EVs的关键货物。通过EVs包装和转移蛋白质在 HCC 的进展中起着至关重要的作用。蛋白质组学分析中相对高通量的优势在筛选HCC的潜在诊断生物标志物方面显示出巨大前景。通过差异蛋白组学分析,多种EVs蛋白质被鉴定为潜在的候选生物标志物组。同核酸和蛋白质一样,代谢物也是 EVs携带的重要分子类型。EVs的代谢组主要包含脂质、氨基酸、有机酸、肉碱、类固醇、维生素、糖及其复合物以及核苷酸和核苷等。代谢物代表基因、转录产物和蛋白质之间多重反应的下游产物,可提供更全面的分子视角,因此更有可能揭示生物状态的动态变化。但是涉及EVs中存在的完整代谢物的研究还较少,迄今为止报道的关于EVs的代谢分析主要集中在脂质上。脂质不仅参与构建EVs膜的结构,在EVs形成和释放到细胞外环境过程中也发挥着重要的作用。随着脂质组学分析方法的发展,鉴定基于脂质的新型生物标志物越来越受到研究人员的关注。单一组学分析方法可以提供不同生命进程或者疾病组与正常组相比差异的生物学过程的信息。但是,这些分析往往有局限性,不能提供关于与 DNA、RNA、蛋白质和代谢物相互作用的信息。最重要的问题是标记物最终是否有能力在临床实践中测试疗效。因此,多组学的结合是发现早期癌症诊断标志物的另一个有前景的方向。通过对不同组学方法获得的数据进行综合分析,有望为复杂的生物系统提供新的见解,并揭示所有分子水平过程之间的相互作用网络。EVs多组学分析的优势在于,通过分析EVs中的各种活性分子组成,可以更准确地确定EVs的来源、生物学功能和作用机制,从而揭示其在生理和疾病中的作用,为临床诊断和治疗提供理论依据。同时,EVs多组学分析具有高通量、高灵敏度、高特异性、非侵入性等特点,可以同时分析多种类型的分子,从而提高研究效率和准确性。随着多组学诊断工具的发展以及数据集成的新计算方法的开发,在未来结合 EVs 和多组学对早期HCC的诊断会有更深入的了解和进步。自1998年首次发现EVs的免疫治疗潜力后,以EVs为中心的新型癌症免疫疗法得到了广泛探索。最近,EVs已被提出作为一种无细胞治疗策略,在肿瘤免疫治疗领域引起了相当大的关注。一些针对巨噬细胞的工程化EVs治疗候选物已被证明可以将TAM重编程为促炎M1表型并增强其对HCC的抗肿瘤免疫力。免疫细胞衍生的 EVs 也具有用于HCC 癌症免疫治疗的潜力。如树突状细胞(DC)衍生的EVs(DEX)在静脉内给药后可以在HCC小鼠中引发强烈的抗原特异性抗肿瘤免疫反应和显着的肿瘤消退。EVs 在 HCC 免疫治疗中的另一个潜在用途是增强免疫检查点抑制剂(ICI)的疗效,通过阻断肿瘤细胞衍生的EVs分泌的PD-L1可以抑制肿瘤生长,并可能克服对抗PD-L1抗体的耐药。除了作为运输各种分子的载体外,EVs还可以作为屏障,通过将内部与外部隔离来保护内容物处于相对稳定的环境中。利用EVs封装溶瘤腺病毒可以提高病毒感染率,并保护其免受中和抗体的侵害,从而显著提高溶瘤病毒疗法的疗效。总之,EVs可以通过一种或多种策略发挥免疫治疗作用,为HCC免疫治疗提供了新思路。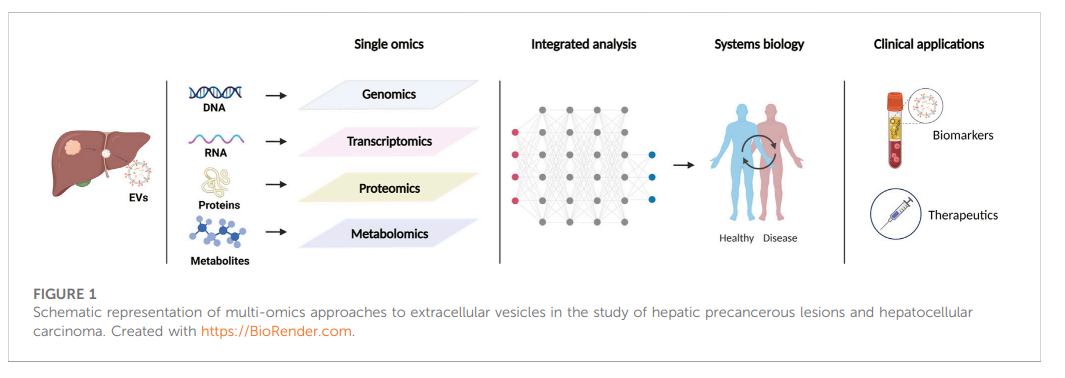
Advances of multi-omics applications in hepatic precancerous lesions and hepatocellular carcinoma: The role of extracellular vesicles. Front Mol Biosci. 2023, Mar 16;10:1114594. doi: 10.3389/fmolb.2023.1114594.
外泌体资讯网 Front Mol Biosci | 上海中医药大学高月求及余卓教授团队:细胞外囊泡多组学应用在肝癌及癌前病变中的进展