根据2023年的全球统计数据,乳腺癌(BC)是女性最常见的恶性肿瘤,也是引起全球女性癌症相关死亡的第二大原因。乳腺癌死亡病例中有90%死亡原因是发生了转移,乳腺癌肺转移是最常见的转移类型之一,其发生机制目前尚不明确,在临床上也缺乏有效的转移标志物和治疗手段。因此研究乳腺癌肺转移的具体机制,寻找合理特异的转移筛查标志物,发现新的治疗干预靶点,对于优化乳腺癌临床治疗具有重要意义。
近日,南昌大学江西医学院熊丽霞教授团队成员在生物医学1区杂志Theranostics (2021 IF: 11.600)上发表题为“Tumor-derived Cav-1 promotes pre-metastatic niche formation and lung metastasis in breast cancer”的研究论文,报道了乳腺癌细胞外泌体源性窖蛋白-1(Cav-1)诱导肺预转移微环境(PMN)形成的分子机制,探索乳腺癌肺转移的创新诊疗靶点。
肿瘤转移是一个受多因素、多阶段调控的过程。目前研究发现,肿瘤的远处器官转移受肿瘤细胞和转移脏器微环境间相互作用的驱动,肿瘤细胞通过“驯化”远处转移器官的细胞,形成利于肿瘤细胞定植生长的“预转移微环境(PMN)”,为转移性肿瘤细胞“种子”定植做准备,促进肿瘤转移。外泌体作为携带生物信号的微小囊泡,近年来在许多肿瘤中发现具有传递生物信息和“驯化”远隔器官形成PMN的作用。外泌体通过转运其包裹的“货物”介导细胞间、细胞与基质间通讯。Cav-1是细胞质膜微囊的功能蛋白,与细胞内外物质的转运、细胞的内吞以及细胞信号通路调节等功能相关。团队前期研究发现Cav-1与转移相关的不同过程有关,如上皮-间质转化(Epithelial mesenchymal transition,EMT),细胞迁移,ECM降解与沉积,以及血管生成。虽然有研究表明Cav-1水平在晚期癌症患者中升高,但Cav-1是否通过乳腺癌外泌体影响PMN的形成而促进BC肺转移尚未有报道。
在此项研究中,研究人员通过分析原发肿瘤微环境与继发肿瘤微环境之间的细胞通讯,以PMN的形成为重点,阐述Cav-1在BC肺转移中的具体作用和机制。为了证实外泌体是否可以作为Cav-1的运输载体,首先发现表达不同Cav-1的BC细胞来源的外泌体中Cav-1的含量不同,共聚焦显微镜定位显示,BC来源的Cav-1可以从外泌体传输到肺上皮细胞。再比较含Cav-1外泌体对侵袭性和非侵袭性乳腺癌细胞的生物学效应。此外,体内实验通过注射含Cav-1外泌体驯化原位乳腺肿瘤小鼠,观察乳腺癌来源外泌体在体内的作用,进一步证实含Cav-1外泌体在肺PMN形成中的作用。体外实验采用多种方法观察含Cav-1外泌体对 肺上皮细胞PMN相关基因CCL2、s100a8的表达,肺成纤维细胞细胞外基质蛋白emilin1, nidogen、TnC and FN的表达,肺巨噬细胞M2型极化过程,揭示了PMN形成的调控机制。
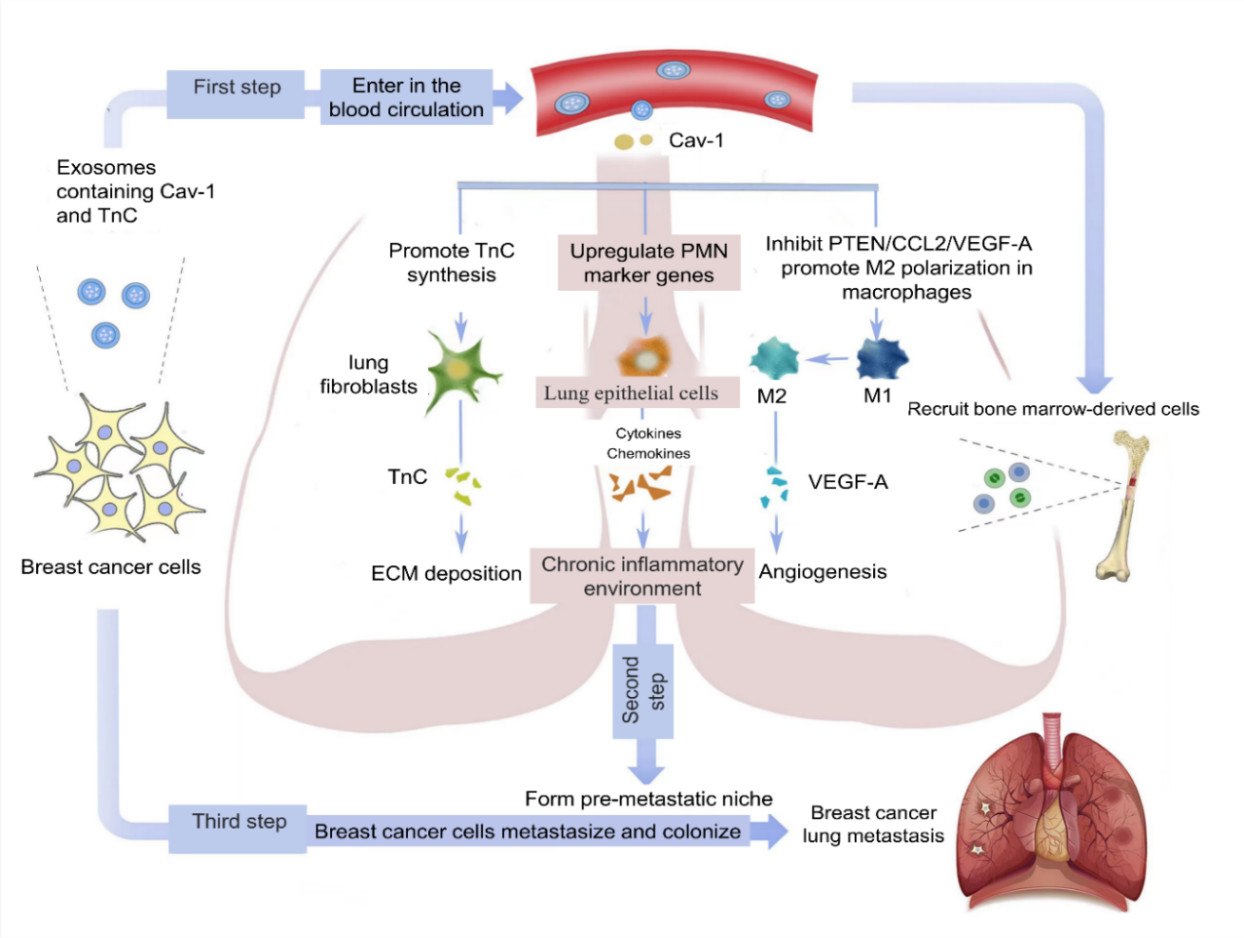
该研究发现外泌体Cav-1在原发乳腺癌和转移性器官微环境之间具有关键功能。乳腺癌源性外泌体中的Cav-1可作为信号分子介导细胞间通讯,调节肺上皮细胞中PMN标记基因和炎症趋化因子的表达,促进肺成纤维细胞中tenascin-C (TnC)分泌引起细胞外基质沉积,抑制肺巨噬细胞中PTEN/CCL2/VEGF-A信号通路促进其M2型极化和血管生成,从而调控肺预转移微环境的形成。这项研究系统性探究乳腺癌细胞外泌体源性Cav-1诱导肺PMN形成的分子机制,以预转移微环境塑造为核心,通过解析肿瘤原发与继发微环境之间细胞通讯,为研究乳腺癌肺转移的机制提供新的方向。
南昌大学江西医学院熊丽霞教授为文章的通讯作者,课题组成员王怡和李雨秋为文章的并列第一作者。
参考文献:
Tumor-derived Cav-1 promotes pre-metastatic niche formation and lung metastasis in breast cancer. Theranostics 2023; 13(6):1684-1697.
外泌体资讯网 Theranostics | 南昌大学江西医学院熊丽霞教授团队发现肿瘤来源外泌体窖蛋白-1促进乳腺癌肺预转移微环境形成





