ARDS患者患有严重的难治性低氧血症、肺泡毛细血管屏障功能障碍、肺表面活性物质功能受损以及炎症通路异常上调,导致重症监护室入院、住院时间延长和残疾调整生命年增加。目前,ARDS没有治愈或FDA批准的治疗方法。近日,Advanced Materials杂志上的一篇文章描述了基于工程化细胞外囊泡(eEV)的纳米载体的实施,用于靶向非病毒递送抗炎荷载物到受损肺部,以减轻ARDS期间的炎症、组织损伤。
急性呼吸窘迫综合症(ARDS)对全球卫生系统来说是一个重要的负担,ARDS患者需要重症监护、长时间住院和缓慢的康复。ARDS患者的死亡率很高,介于25%至40%之间。ARDS是急性肺损伤的最严重形式,通常由于直接或间接损伤肺部(例如感染、创伤、肺炎、失血性休克等)引起。一旦肺部受损,就会显著上调促炎症途径,大量中性粒细胞被招募,并分泌大量促炎细胞因子和其他介质。尽管炎症对于解决潜在疾病至关重要,但过度炎症会导致毛细血管损伤,并进一步破坏肺泡毛细血管屏障,随后大量富含蛋白质的液体涌入肺泡空间。这种水肿液在间质和肺泡空间的积累会导致气体交换受损,并导致氧合不良、二氧化碳排出减少、肺顺应性降低,最终导致急性呼吸衰竭。对于ARDS患者,机械通气用作支持性治疗以维持足够的氧合。然而,在通气期间施加的机械应力会加剧初始损伤并触发一个有利于炎症的正反馈循环,这可能导致多器官功能/衰竭和死亡。目前,ARDS没有治愈方法或FDA批准的治疗方法。考虑到最近的COVID-19大流行,67%的COVID-19患者已经发展成ARDS,肺部炎症在决定临床结果方面起着关键作用,这种未满足的临床需求尤其重要。尽管已经探索了祖细胞治疗(例如内皮祖细胞和间充质干细胞)以通过营养和抗炎机制(例如通过分泌多种效应分子,包括抗炎细胞因子、生长因子和抗微生物肽)减少炎症并增强肺部修复,但仍然存在重大问题,例如潜在的肿瘤发生、高免疫原性反应、有限的细胞来源、繁琐和劳动密集的离体处理以及有效的传递方法。另一方面,虽然使用抗炎方法治疗ARDS的病理生理学已经显示出显著的前景,但在危重病患者中有效地传递到受感染的肺环境仍然是一个重大挑战。细胞外囊泡(EV)是细胞衍生的天然载体,发挥着在短程和长程细胞间通信中的关键作用,并与其供体细胞共享分子信号。已知EV在生物流体中表现出高稳定性、低免疫原性和卓越的生物相容性。此外,EV具有跨越生物屏障、运输和传递各种活性生物分子(包括蛋白质、抗原和核酸等)的固有能力,而且大小上没有显著限制。尽管EV仍然面临一些限制(例如异质性、标准化隔离和纯化方案的匮乏以及用于临床使用的大规模生产),但它们已经成为有前途的药物和基因传递纳米载体,能够规避标准纳米载体系统所面临的一些实际和翻译障碍。我们之前已经展示了,供体细胞可以被工程化,以刺激装有特定分子货物的工程化外泌体(eEVs)的释放,用于各种治疗应用,而且eEVs可以被功能化,用感兴趣的配体实现对细胞和组织的靶向传递。在这里,我们报道了从皮肤成纤维细胞中衍生出的eEVs,装载了抗炎细胞因子白介素-4和-10(IL-4和IL-10)的基因、mRNA转录本和蛋白质含量,以减轻肺损伤和炎症,并装饰有表面活性蛋白A(SPA),以促进在受损肺部的细胞区域中的优先保留。SPA是存在于肺表面活性物质中的丰富糖蛋白成分,它参与降低肺泡空气液界面的表面张力、预防肺泡塌陷,并被认为是主要的炎症免疫调节因子。鉴于此,在实现对肺部的靶向传递之外,eEVs中SPA mRNA转录本的存在可能会增强对肺部炎症的抑制作用,因为它在维持肺微环境中的免疫稳态方面发挥作用。这些抗炎eEVs是从成年小鼠皮肤成纤维细胞的非病毒电转染24小时后衍生出来的。我们的结果突出了装载IL-4和IL-10的eEVs减轻脂多糖(LPS)诱导的肺部炎症和组织损伤的能力,无论是体外还是体内。在体外,我们观察到显著的抗炎细胞因子分泌(IL-6、IL-1β和TNF-α)和巨噬细胞活化的减弱。在体内,我们还观察到,在治疗后6小时,用装载IL-4和IL-10的eEVs处理的小鼠中,显著减少了分泌的促炎性细胞因子(IL-6、IL-1β和TNF-α)、富含蛋白质的液体流入肺泡空间、中性粒细胞浸润和组织损伤。体内研究表明,将eEVs装饰为SPA靶向配体可以改善肺内eEV保留。代谢组学分析还表明,抗炎eEVs对LPS挑战小鼠的代谢谱有显著影响,通过诱导与关键抗炎代谢物相关的代谢物的分泌。这些结果证实了通过非病毒方法获得的抗炎eEVs在减轻ARDS期间肺部损伤和流行/进展炎症方面的潜力。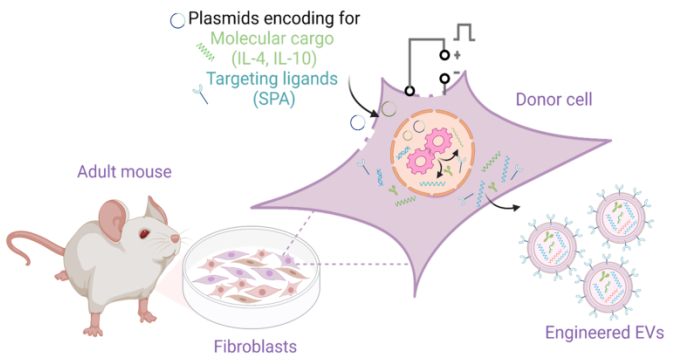
ARDS患者患有严重的难治性低氧血症、肺泡毛细血管屏障功能障碍、肺表面活性物质功能受损以及炎症通路异常上调,导致重症监护室入院、住院时间延长和残疾调整生命年增加。目前,ARDS没有治愈或FDA批准的治疗方法。该研究描述了基于工程化细胞外囊泡(eEV)的纳米载体的实施,用于靶向非病毒递送抗炎荷载物到受损肺部。结果表明,表面活性蛋白A(SPA)功能化的IL-4和IL-10装载的eEVs能够促进肺内保留并减少体内外的炎症。我们观察到,在eEVs处理后6小时,组织损伤、促炎性细胞因子分泌、巨噬细胞活化、富含蛋白质的液体流入和中性粒细胞浸润到肺泡空间中都有显著减轻。此外,代谢组学分析显示,eEV治疗导致受损肺部代谢谱发生显着变化,促进了关键抗炎代谢物的分泌。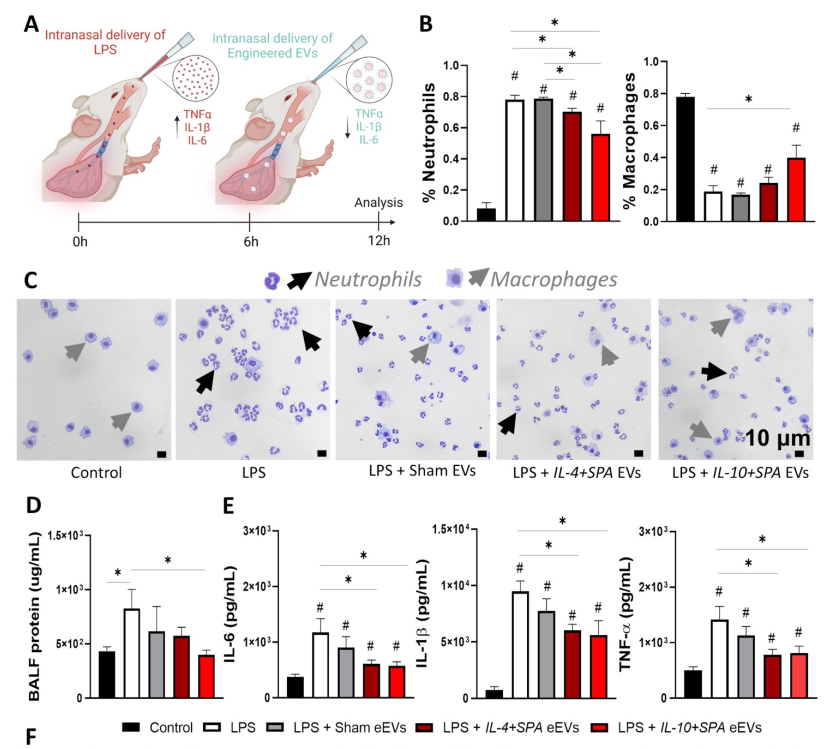
载有IL-4和IL-10的SPA功能化eEV在体内抑制LPS诱导的肺部炎症和组织损伤总之,这些结果证实了通过非病毒递送抗炎基因/转录本,从皮肤成纤维细胞中获得的eEVs在减轻ARDS期间的炎症、组织损伤和流行/进展方面具有潜力。Salazar-Puerta AI, Rincon-Benavides MA, Cuellar-Gaviria TZ, Aldana J, Martinez GV, Ortega-Pineda L, Das D, Dodd D, Spencer CA, Deng B, McComb DW, Englert JA, Ghadiali S, Zepeda-Orozco D, Wold LE, Gallego-Perez D, Higuita-Castro N. Engineered Extracellular Vesicles Derived from Dermal Fibroblasts Attenuate Inflammation in a Murine Model of Acute Lung Injury. Adv Mater. 2023 Apr 29:e2210579. doi: 10.1002/adma.202210579. PMID: 37119468.外泌体资讯网 Adv Mater:工程化细胞外囊泡减轻急性肺损伤小鼠模型中的炎症







