癌症会改变多个器官的功能,不只是转移的目标器官。近日,康奈尔大学Weill Cornell Medicine科学家/外泌体与肿瘤领域大牛David Lyden教授等在Nature杂志发表文章,报道发现肿瘤来源的细胞外囊泡和颗粒(EVPs)是癌症诱导的肝重编程的关键介质。EVPs病理性地改变肝脏,使其转向炎症状态,导致脂肪堆积并损害其正常的解毒功能。这一发现揭示了癌症更为隐匿的生存机制之一,并暗示了可能出现新的检测和药物来检测和逆转这一过程。
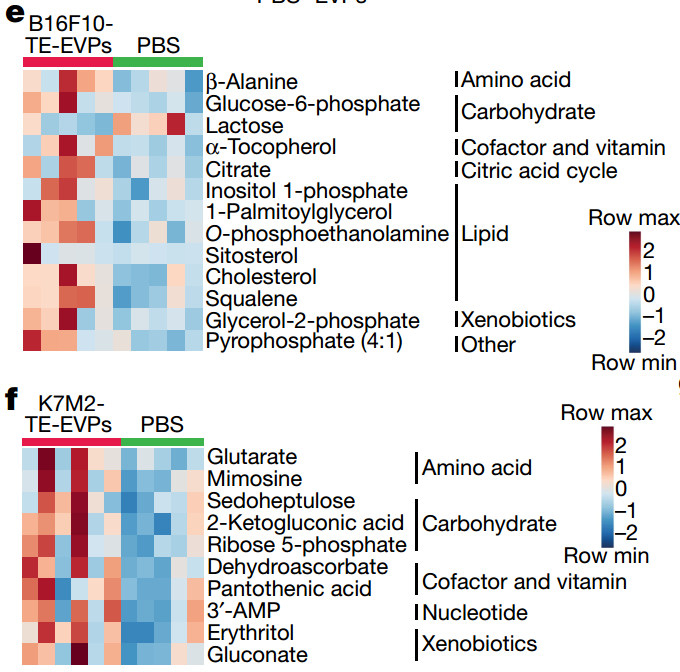
癌症是一种通过释放可溶性因子(包括EVPs)介导的系统性疾病。肿瘤来源的EVPs在多个无转移器官中建立了前转移微环境(PMNs)并重编程了细胞功能。在癌症进展过程中,即使没有转移,肝脏也被确定为肿瘤来源的EVPs主要靶向器官之一,促使作者调查EVPs在改变肝功能方面的作用。该研究通过对多个小鼠肿瘤模型和患有癌症的肝组织,应用多组学分析,证明了包装在肿瘤EVPs中的饱和脂肪酸诱导代谢紊乱,从而促进脂肪肝形成并降低肝脏的药物代谢能力。
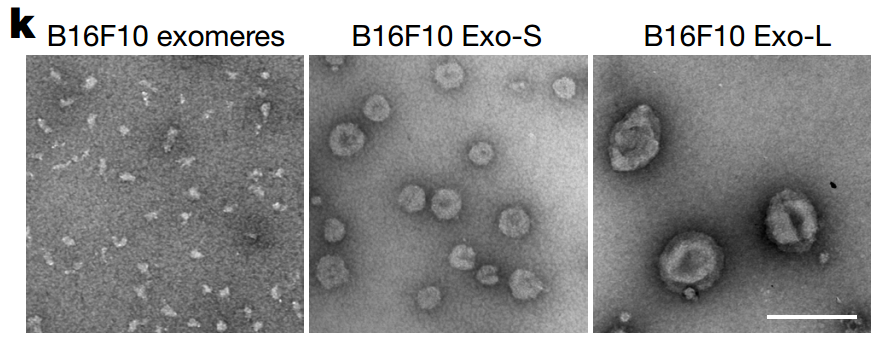
该研究展示了炎症、脂肪肝和代谢紊乱是小鼠模型和患有肝外转移的患者中系统性受影响的肝脏的标志。研究确定了肿瘤来源的细胞外囊泡和颗粒(EVPs)是癌症诱导的肝重编程的关键介质,通过减少Rab27a抑制肿瘤EVP分泌可逆转这一现象。所有EVP亚群,外泌体和外泌颗粒(exomeres)都可以使肝功能失调。肿瘤EVPs的脂肪酸载体,特别是棕榈酸,通过库普弗细胞诱导肿瘤坏死因子(TNF)的分泌,产生促炎微环境,抑制脂肪酸代谢和氧化磷酸化,并促进脂肪肝形成。通过减少库普弗细胞或抑制TNF可显著降低肿瘤诱导的脂肪肝生成。在TNF依赖性方式下,肿瘤移植或预处理与肿瘤EVPs降低了细胞色素P450基因表达并减弱了药物代谢。作者还观察到,在后来发展为肝外转移的胰腺癌患者中,诊断时存在脂肪肝和细胞色素P450表达下降,突出了该研究发现的临床相关性。值得注意的是,肿瘤EVP教育增强了化疗的副作用,包括骨髓抑制和心脏毒性,这表明通过肿瘤来源的EVPs对肝进行代谢重编程可能限制癌症患者对化疗的耐受性。该研究揭示了肿瘤衍生的 EVP如何让肝功能失调及其靶向潜力,以及 TNF 抑制,该研究发现可指导防止脂肪肝形成和增强化学疗法的疗效。
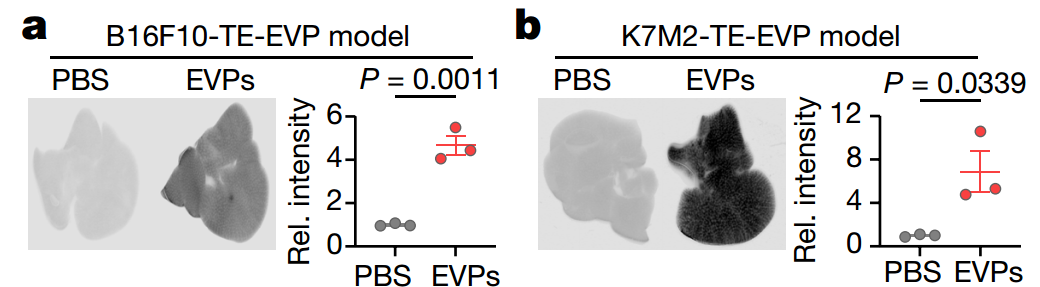
小鼠肝脏对肿瘤EVP的摄取
该研究展示了远程肿瘤来源的EVPs在无肿瘤小鼠肝脏中诱导炎症并下调脂质分解,重编程小鼠和癌症患者的代谢。机制上,肿瘤EVPs中的棕榈酸引起Kupffer细胞中TNF的分泌,从而促进脂肪肝形成。通过敲除肿瘤细胞中的Rab27a、减少库普弗细胞或阻断TNF来阻止EVP分泌可以挽救这些表型。外泌颗粒(exomeres)是主要靶向肝脏的EVP,是导致脂肪肝形成的主要贡献者。
脂肪肝生成与肝前转移微环境(PMNs)形成之间存在反向关系,因为肝靶向肿瘤EVPs刺激库普弗细胞分泌TGFβ以激活星形细胞并产生纤维化的PMN,而具有肝外转移倾向的肿瘤通过EVP介导的库普弗细胞TNF分泌诱导脂肪肝。此外,外泌体亚群靶向PMN器官,而外泌颗粒主要靶向肝脏,促进脂肪肝形成。进一步解剖EVP货物和每个亚群内的功能异质性对于解密促进PMN形成和转移机制与癌症旁效应至关重要。EVP包装的棕榈酸改变非转移性肝功能,与PMNs中棕榈酸的效应不同。
肿瘤衍生的EVPs诱导肝代谢功能障碍
EVP诱导的脂肪肝可能提供能量以支持其他部位的肿瘤生长,这与NAFLD增加肝外癌症风险的报告一致。除了肿瘤支持外,肝代谢紊乱可能具有多器官系统效应,通过增加胆固醇和甘油三酯的产生来促进心血管疾病;损害免疫功能,如T细胞功能;或促进消瘦。
该报道强调了需要考虑癌症的系统效应来进行癌症治疗。恢复肝功能的策略对于最小化副作用和增强通过肝代谢的化疗药物的治疗反应至关重要。肿瘤EVP诱导的TNF分泌下调Cyp基因并损害肝药物代谢,将化疗与TNF抑制剂相结合可能会恢复正在接受癌症治疗的患者的肝功能。应该考虑减少肿瘤EVP产生的策略,因为它们将防止肝代谢功能障碍以及抑制PMN形成。最后,恢复正常的肝功能也可以预防与癌症相关的进一步系统性病理(如心血管疾病)。
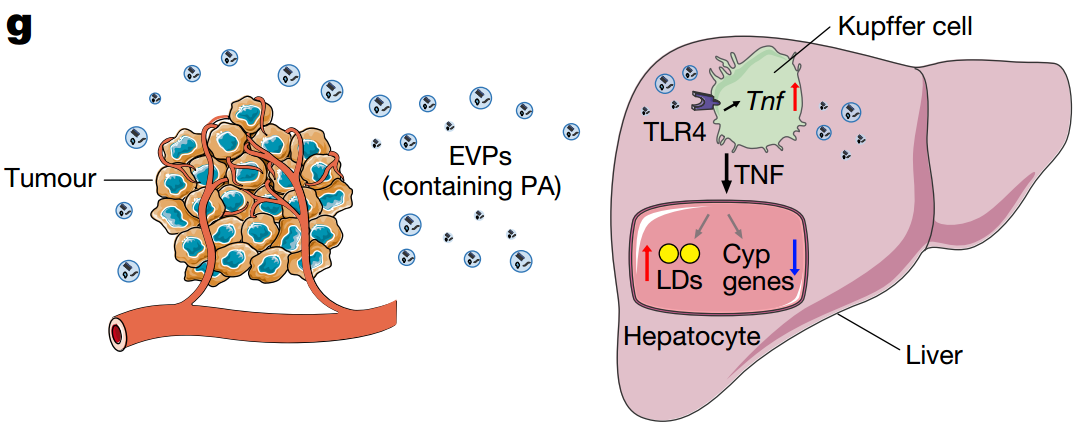
EVP介导的肝脏代谢失调的模型示意图。肿瘤衍生的EVP靶向肝脏中的Kupffer细胞。EVP包装的饱和脂肪酸,如棕榈酸 (PA),以 TLR4 依赖性方式刺激枯否细胞分泌TNF。 这会在肝脏中产生促炎微环境,从而全身性地诱导脂肪肝形成并抑制肝脏的药物代谢活性。
“我们的研究结果表明,肿瘤可以导致重大的系统性并发症,包括肝脏疾病,但也暗示了这些并发症可以通过未来的治疗得到解决,”David Lyden博士说。
在过去的20年中,Lyden博士及其研究小组一直在研究癌症的系统性影响。这些影响反映了癌症用来确保其生存和加速其进展的特定策略。例如,在他们2015年发表的工作中,该团队发现胰腺癌分泌包含在细胞外囊泡中的分子,这些分子通过血液循环传播,被肝脏吸收,并准备好支持新的转移性肿瘤生长。
在这项新研究中,研究人员发现了一组不同的肝脏变化,这些变化是由远处的癌细胞引起的,他们在转移到其他器官但不转移到肝脏的骨癌、皮肤癌和乳腺癌的动物模型中观察到。该研究的关键发现是,这些肿瘤会导致肝细胞中脂肪分子的积累,从而以类似于与肥胖和酗酒有关的脂肪肝病的方式重编程肝脏。
该团队还观察到,重编程后的肝脏具有高水平的炎症,标志为肿瘤坏死因子-α(TNF-α)水平升高,并且细胞色素P450这种药物代谢酶水平较低,这种酶可以分解潜在有毒分子,包括许多药物分子。观察到细胞色素P450水平降低可能解释了为什么随着患者病情进展,癌症患者经常变得对化疗和其他药物的耐受性降低。
研究人员将这种肝重编程追溯到远处肿瘤释放的EVPs上,这些EVPs携带脂肪酸,特别是棕榈酸。当被称为库普弗细胞的定居于肝脏内的免疫细胞吸收这些脂肪酸时,它们会触发TNF-α的产生,从而驱动脂肪肝形成。
尽管在该研究中主要使用了癌症动物模型,但他们观察到新诊断出胰腺癌患者的肝脏也出现了类似变化,这些患者后来发展出非肝转移。
“这种EVP诱导的脂肪肝病并不与肝转移同时发生,这表明引起脂肪肝和准备肝脏转移是癌症用于操纵肝脏功能的不同策略,”该研究的共同第一作者、Lyden实验室的博士后研究员Gang Wang博士说。Lyden实验室的科学合作者Jianlong Li博士也是该研究的共同第一作者。
科学家们怀疑,脂肪肝病有助于癌症生长,部分原因是将肝脏转化为基于脂质的能源来源,以推动癌症生长。
“我们在肝细胞中不仅看到了脂肪的异常积累,而且还看到了从正常的脂质处理中转变出来的脂质,因此正在产生的脂质对癌症更有利,”该研究的共同高级作者、康奈尔医学院麦耶癌症中心成员、麦迪逊广场纽约长老会/康奈尔医学中心的肝病专家、胃肠病和肝胆胰内科副教授Robert Schwartz博士说。
这种肝脏改变可能不是癌症从中获得的唯一好处。康奈尔医学院儿科细胞和发育生物学助理教授Haiying Zhang博士说:“免疫细胞功能中也涉及到关键分子,但它们的产生在这些脂肪肝中发生了改变,暗示这种情况也可能削弱抗肿瘤免疫力。”
研究人员通过阻止肿瘤-EVP释放、抑制棕榈酸包装到肿瘤EVP中、抑制TNF-α活性或消除实验动物模型中的库普弗细胞等方法,成功缓解了肿瘤对肝脏的系统影响。研究人员正在进一步调查在人类患者中实施这些策略以阻止肿瘤对肝脏的远程影响的潜力,并探索利用检测循环于血液中的肿瘤EVP中的棕榈酸作为晚期癌症的潜在预警信号的可能性。