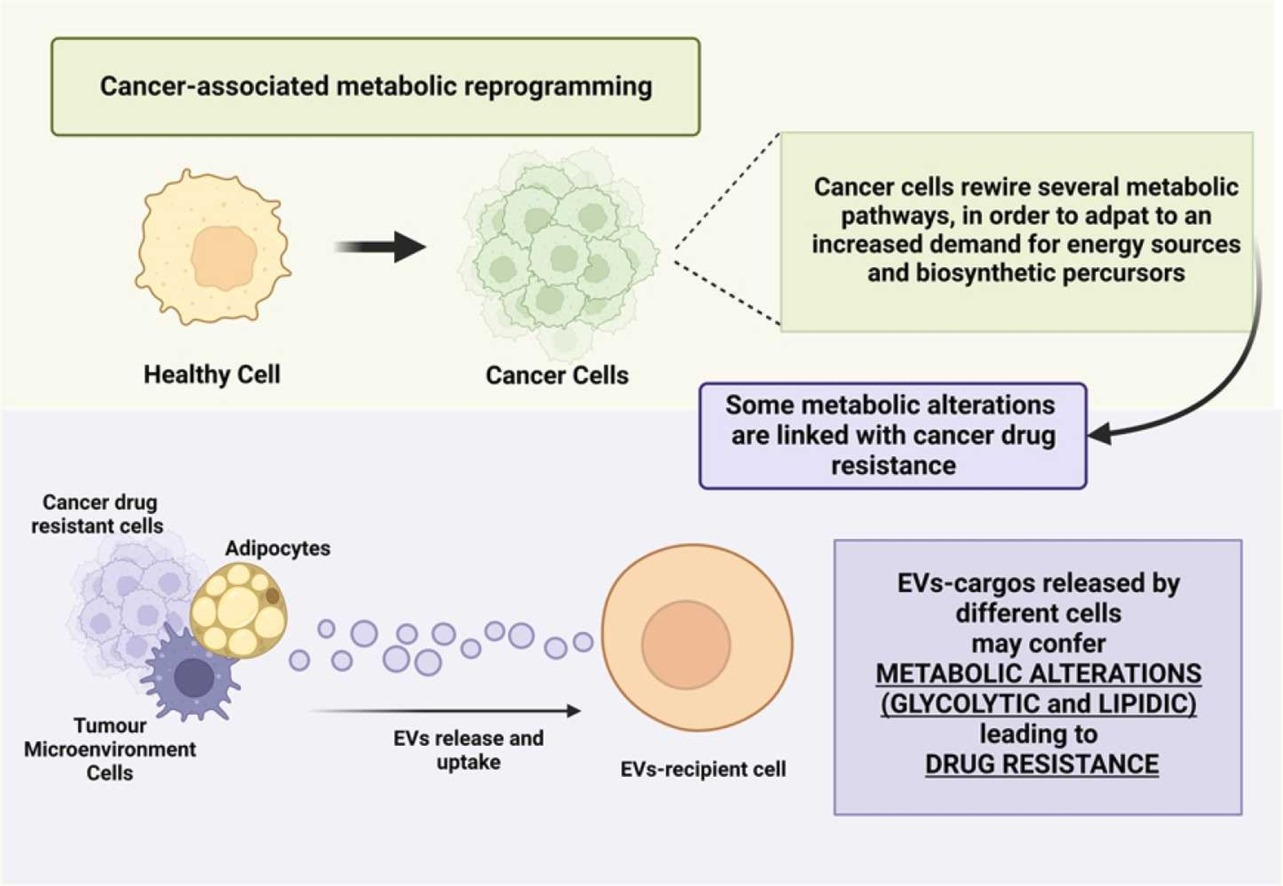
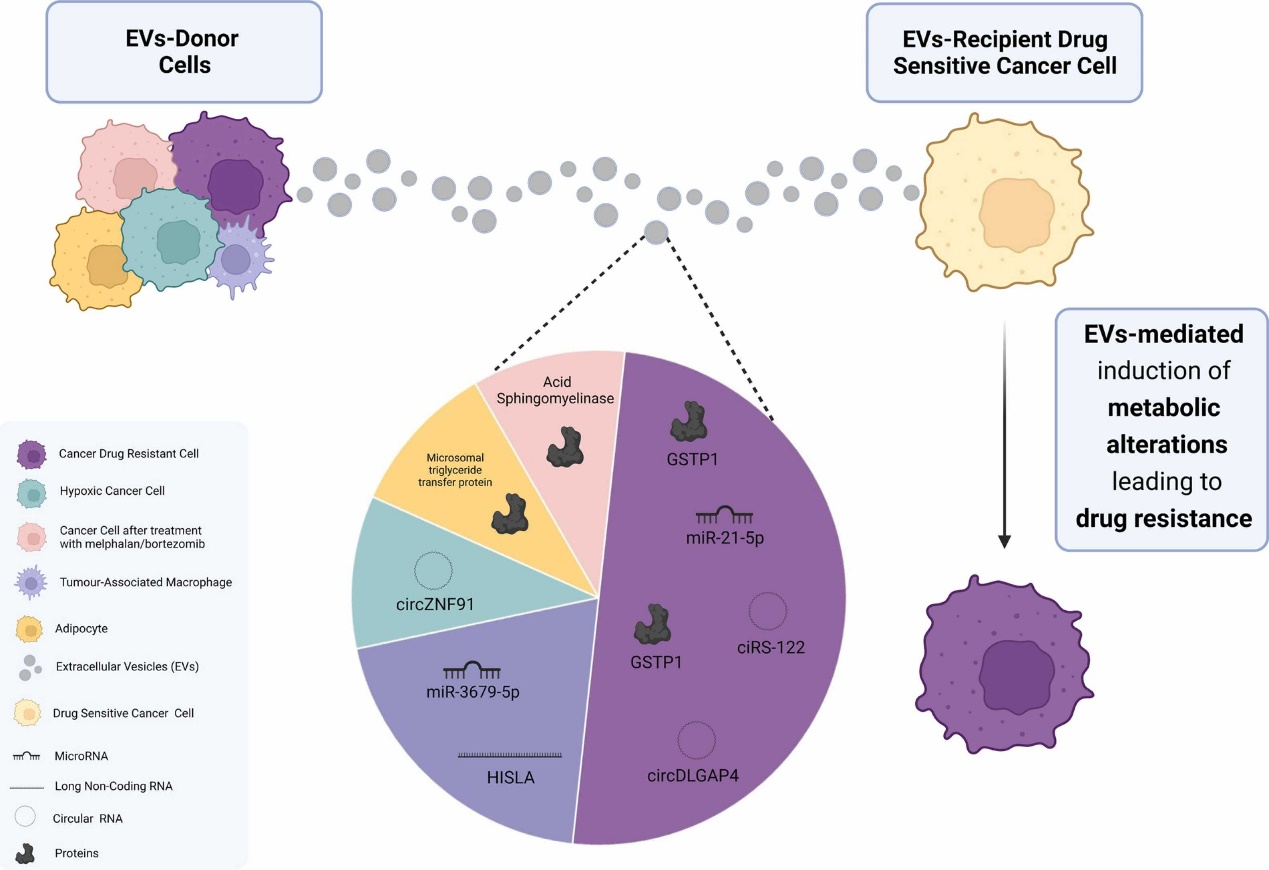
葡萄糖代谢和脂质代谢的改变被认为是肿瘤细胞生长和增殖的相关因素,这些代谢改变会在肿瘤细胞中诱导耐药表型。有证据表明,细胞外囊泡(EVs)在细胞间通讯中起着至关重要的作用,可能通过调节肿瘤细胞代谢的几个方面来促进肿瘤的进展、生存和耐药性。来自葡萄牙波尔图大学的研究人员收集了肿瘤代谢重编程的相关数据,对糖酵解和脂质改变其对耐药的影响进行了总结,并强调EV作为该过程的细胞间介质的相关性。相关综述性内容以“The role of Extracellular Vesicles in glycolytic and lipid metabolic reprogramming of cancer cells: Consequences for drug resistance”为题于5月12日在线发表在国际细胞生物学领域学术期刊Cytokine and Growth Factor Reviews杂志上。
肿瘤细胞代谢的重编程是肿瘤新出现的标志特征之一。肿瘤细胞作为快速增殖的细胞,其特点是对能量来源和生物合成大分子的需求增加。因此,一些代谢和生物合成途径,包括葡萄糖、脂质和氨基酸代谢被异常调控。糖酵解和氧化磷酸化(OXPHOS)是细胞以三磷酸腺苷(ATP)形式产生所有生物过程所需能量的两种主要代谢途径。OXPHOS是正常细胞在非增殖条件下优先使用的代谢途径。由于它需要氧气,因此也被称为有氧呼吸,并负责将糖酵解产物丙酮酸转化为乙酰辅酶A(acetyl- CoA),然后将转移到三羧酸循环(TCA)和电子传递链。这一过程发生在线粒体中,每个葡萄糖分子净增加36个ATP分子。另一方面,糖酵解,由于缺乏对氧的依赖,通常被称为无氧呼吸,发生在细胞质中,并导致丙酮酸转化为乳酸。在这个过程中,只产生2个ATP分子。虽然糖酵解的效率较OXPHOS低,但ATP的产生速度更快。在20世纪20年代,Otto Warburg首次证明,与正常细胞不同,大多数肿瘤细胞以糖酵解作为ATP的主要来源,表现出比正常细胞更高的葡萄糖摄入量。即使在氧气存在下,糖酵解也是肿瘤细胞首选的,因此被称为“有氧糖酵解”。这种发生在肿瘤细胞中的代谢变化通常被称为“Warburg效应”。糖酵解效率低下,Warburg效应似乎违反常理,因此提出为什么肿瘤细胞更喜欢糖酵解。第一种假说是肿瘤细胞中线粒体可能存在功能障碍。然而,这一理论被否定了,因为有大量证据表明肿瘤细胞能够维持线粒体的功能性活性。重要的是,肿瘤糖酵解的优点之一是ATP的持续和加速生产,从而加速大分子的生物合成,包括核苷酸、脂质、氨基酸、NAD+、NADPH等,这些都是满足快速增殖细胞需要的物质和氧化还原辅助因子。此外,二氧化碳和活性氧(ROS),如超氧化物和过氧化氢,作为OXPHOS途径的亚产物被释放。释放的ROS可导致多种细胞过程,包括导致细胞死亡的DNA损伤,对肿瘤细胞有害。因此,从OXPHOS到糖酵解途径的转变对肿瘤细胞是有利的,因为ROS的产生减少,避免了DNA损伤和细胞凋亡。尽管葡萄糖代谢可能是最常见的代谢改变,但肿瘤中也发生了其他相关的代谢变化,尤其是脂质代谢。脂质在所有细胞中都发挥着重要的生物学作用,作为额外的能量提供者、质膜形成、激素和细胞信号传导过程中的第二信使。有趣的是,正常细胞和肿瘤细胞的脂质组成不同,取决于肿瘤类型。细胞膜脂质主要是磷脂、甾醇和鞘脂。所有这些分子都是由乙酰辅酶A合成的,大多数含有脂肪酸(FAs)。在正常细胞中,FAs原料通常直接从外源获得。但是,肿瘤细胞表现出FAs从头合成途径的激活。FAs生物合成的上调使肿瘤细胞能够满足其对胆固醇和脂质增加的需求。参与FAs合成的酶类在不同类型的肿瘤中上调,如脂肪酸合成酶(FAs)、乙酰辅酶A羧化酶(ACC)和ATP-柠檬酸裂解酶(ACLY)。值得注意的是, 抑制FAs合成减慢了肿瘤生长,表明FAs和脂质是肿瘤生长的必需成分。此外,FAs的其他作用,例如它们重塑膜结构和流动性的能力、作为促肿瘤信号分子的作用以及对肿瘤微环境(TME)的影响。另一方面,线粒体中的FA氧化(FAO)在不同类型的肿瘤中上调,并通过在葡萄糖受限时作为额外的能量来源促进肿瘤的存活和增殖。在此过程中产生的NADH可以保护肿瘤细胞免受氧化应激。除了FAs代谢外,通过甲羟戊酸途径的胆固醇和类异戊二烯类生物合成在肿瘤细胞中也发生了改变。甲羟戊酸途径活性对于肿瘤细胞系的存活也至关重要。包括谷氨酰胺在内的氨基酸代谢在肿瘤中也被认为是上调的。谷氨酰胺是能量产生的主要底物,其代谢中间体,如α-酮戊二酸和TCA循环干预剂,是肿瘤细胞的额外能量来源。因此,肿瘤细胞中谷氨酰胺代谢增加,以适应糖酵解途径的改变。此外,谷氨酰胺代谢影响了几种致癌信号通路,包括原癌基因MYC的过度表达,MYC可促进谷氨酰胺转运体、谷氨酰胺酶和谷氨酰胺合成酶的上调表达。肿瘤代谢的改变与肿瘤治疗耐药的发展有关,针对这些代谢途径开发新的肿瘤治疗策略的可能性也被讨论。肿瘤耐药的发生有多种机制,通常与宿主因素、TME或肿瘤因子有关。宿主因素包括遗传变异、药物靶点突变和药物-药物相互作用,TME因素来源于肿瘤与周围细胞之间的通讯,如成纤维细胞和巨噬细胞。肿瘤细胞可能通过增强逃避细胞死亡的机制,加剧DNA损伤反应和修复机制,改变miRNAs的表达,增加多药耐药(MDR)ABC转运体的表达,导致更高的药物外排,从而使细胞内药物浓度降低。通过细胞外囊泡(EVs)的细胞间通讯是诱导耐药是一种新机制,决定了宿主因子从耐药细胞向敏感细胞的扩散。细胞释放的EV货物可能含有蛋白质、脂质、DNA、RNA等成分,这些成分反映了起源细胞的细胞内状态。由于EV在细胞间通讯中发挥重要作用,介导其生物货物的水平转移,它们可能促进代谢改变向受体细胞的传播。然而,这一过程背后的机制尚不完全清楚。在这篇综述里,研究人员重点介绍了影响耐药的肿瘤代谢重编程过程,主要是糖酵解和脂质代谢重编程,以及这些代谢途径通过EV在细胞间的转移机制。这些机制揭示了耐药细胞或TME细胞释放的EV将与耐药相关的代谢特征转移给药物敏感肿瘤细胞的能力。深入这种细胞间通讯网络有助于开发判断药物反应的标志物,或克服耐药性的治疗靶点。在今后,随着制药生物技术的不断发展和先进疗法的发现,来自敏感细胞的EV也可以作为化疗药物的载体,作为靶向治疗或免疫治疗剂的小分子。这些工程化的EV可以将EV的内源性代谢成分与外源性抗癌药物结合起来,为新的多靶点治疗方法开辟可能。
参考文献:The role of Extracellular Vesicles in glycolytic and lipid metabolic reprogramming of cancer cells: Consequences for drug resistance. Cytokine Growth Factor Rev. 2023 May 14:S1359-6101(23)00021-7.
外泌体资讯网 【综述】Cytokine Growth Factor Rev丨细胞外囊泡调节肿瘤细胞糖酵解、脂质代谢以及肿瘤耐药