细胞外囊泡(EV)可以通过抗原呈递和共刺激或共抑制影响免疫反应。近日,Science Advances杂志上发表一篇文章,对EV进行工程设计,以在1型糖尿病(这是一种T细胞介导的自身免疫疾病)的背景下调节T细胞。
细胞外囊泡(EV)是大多数细胞类型分泌的小型生物活性囊泡,其来源要么来自内吞体,要么来自细胞膜。通常称为外泌体的小型EV(30至150纳米)通过携带蛋白质、核酸、脂质和代谢产物等信息发挥着作为信使的重要作用,这些信息对相互作用的细胞产生影响。EV膜含有富含胆固醇、鞘磷脂和神经酰胺的脂筏,使它们在体液中高度稳定,因此成为治疗的有吸引力的工具。此外,EV是肽主要组织相容性复合物(pMHC)的来源,并且可以以抗原特异性方式与免疫系统多种方式相互作用。鉴于这些优点,EV是治疗开发的有吸引力的模块化工具,并且在许多情况下可以进行改变以补充或增强其潜在治疗适用性。作者的EV工程方法受到内源性EV在疾病环境中(如癌症或自身免疫)的作用的启发。例如,肿瘤细胞外泌体呈现的程序性死亡配体1(PD-L1)在癌症中调节T细胞反应。PD-L1与T细胞上的其受体PD-1结合会导致强烈的T细胞受体(TCR)信号转导和CD28共刺激的对抗,从而抑制T细胞的抗原驱动激活。从外泌体中特异性去除PD-L1会导致强烈的T细胞激活和肿瘤排斥。在自身免疫中,EV已被证明可能通过免疫激活对疾病进展做出贡献。例如,在1型糖尿病(T1D)中,胰岛自身抗原如胰岛素、谷氨酸脱羧酶65和胰岛素瘤相关蛋白2已被鉴定为β细胞EV中的成分,这些成分可以转移到抗原呈递细胞(APC)进行处理并呈递给T细胞。β细胞自身抗原通过这种方式变得可用于免疫系统,可能在T1D的起始和进展中发挥作用。癌症和自身免疫中许多失调的免疫途径可能至少部分地受到EV的贡献的调节。确定EV赋予这些效应的机制可能为有效地在ex vivo环境中工程和利用它们以治疗目的提供见解。该报道研究了工程EV的负调节特性,作为调节T细胞激活和细胞毒性以对抗T1D自身免疫成分的工具。人类白细胞抗原(HLA)分子向T细胞呈现抗原肽以进行免疫监视,已经有充分的文献证明,某些HLA等位基因的特定组合会赋予T1D的遗传风险或保护作用。作者设计了一个体外系统,用于生成和测试携带自身抗原负载的HLA I类分子的EV,使用T1D风险相关的HLA-A * 02(HLA-A2),加上共刺激或不共刺激PD-L1。研究证明了APC在EV介导CD8 + T细胞激活中的重要性,以及CD80在EV介导刺激和抑制中的潜在作用。作者还生成了胰岛自身反应性人类CD8 + T细胞,并表明免疫工程EV在体外减少了T细胞介导的靶细胞杀伤。研究结果为有效的EV工程提供了有价值的见解,并具有组织特异性免疫调节应用。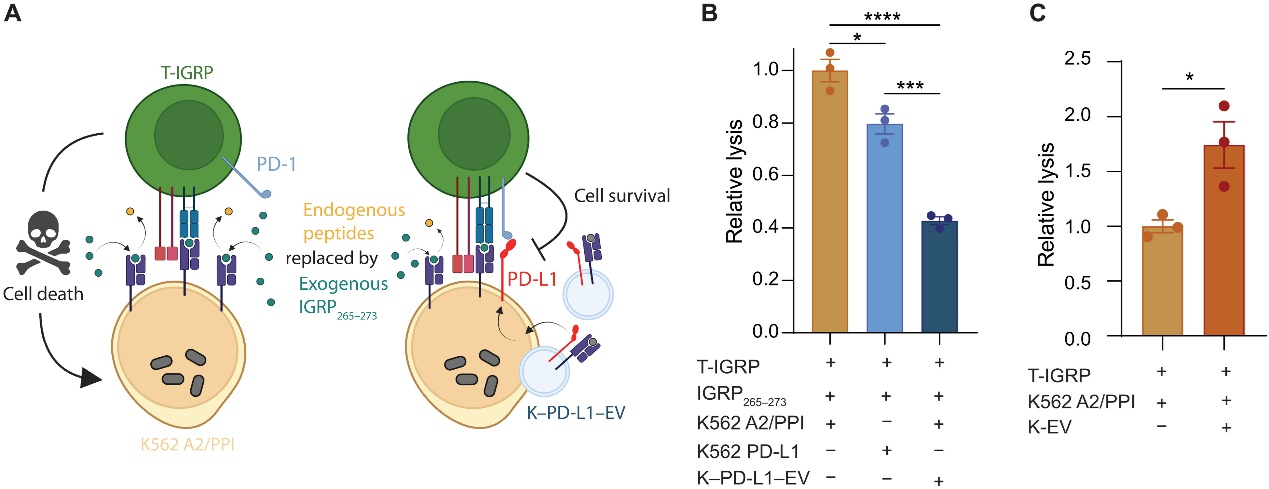 EV PD-L1在体外减少T细胞介导的靶细胞杀伤该研究通过工程淋巴母细胞系K562表达HLA-A * 02(HLA-A2)以及共刺激CD80和/或共抑制程序性死亡配体1(PD-L1)。EV呈现HLA-A2和CD80以剂量、抗原和HLA特异性方式激活CD8+ T细胞。将PD-L1添加到这些EV中会产生免疫调节反应,在体外减少CD8 + T细胞的激活和细胞毒性。EV本身无法在没有抗原呈递细胞的情况下刺激T细胞。缺乏CD80的EV无法调节CD8 + T细胞的激活,这表明EV介导的免疫调节需要肽-HLA复合物和共刺激。这些结果为合理设计EV作为一种无细胞免疫治疗方法提供了机制上的见解,可以定制以促进炎性或耐受性免疫反应。Becker MW, Peters LD, Myint T, Smurlick D, Powell A, Brusko TM, Phelps EA. Immune engineered extracellular vesicles to modulate T cell activation in the context of type 1 diabetes. Sci Adv. 2023 Jun 2;9(22):eadg1082. doi: 10.1126/sciadv.adg1082. Epub 2023 Jun 2. PMID: 37267353.
EV PD-L1在体外减少T细胞介导的靶细胞杀伤该研究通过工程淋巴母细胞系K562表达HLA-A * 02(HLA-A2)以及共刺激CD80和/或共抑制程序性死亡配体1(PD-L1)。EV呈现HLA-A2和CD80以剂量、抗原和HLA特异性方式激活CD8+ T细胞。将PD-L1添加到这些EV中会产生免疫调节反应,在体外减少CD8 + T细胞的激活和细胞毒性。EV本身无法在没有抗原呈递细胞的情况下刺激T细胞。缺乏CD80的EV无法调节CD8 + T细胞的激活,这表明EV介导的免疫调节需要肽-HLA复合物和共刺激。这些结果为合理设计EV作为一种无细胞免疫治疗方法提供了机制上的见解,可以定制以促进炎性或耐受性免疫反应。Becker MW, Peters LD, Myint T, Smurlick D, Powell A, Brusko TM, Phelps EA. Immune engineered extracellular vesicles to modulate T cell activation in the context of type 1 diabetes. Sci Adv. 2023 Jun 2;9(22):eadg1082. doi: 10.1126/sciadv.adg1082. Epub 2023 Jun 2. PMID: 37267353.外泌体资讯网 Sci Adv:免疫工程化的细胞外囊泡在1型糖尿病背景下调节T细胞活化
 EV PD-L1在体外减少T细胞介导的靶细胞杀伤
EV PD-L1在体外减少T细胞介导的靶细胞杀伤 EV PD-L1在体外减少T细胞介导的靶细胞杀伤
EV PD-L1在体外减少T细胞介导的靶细胞杀伤 EV PD-L1在体外减少T细胞介导的靶细胞杀伤
EV PD-L1在体外减少T细胞介导的靶细胞杀伤