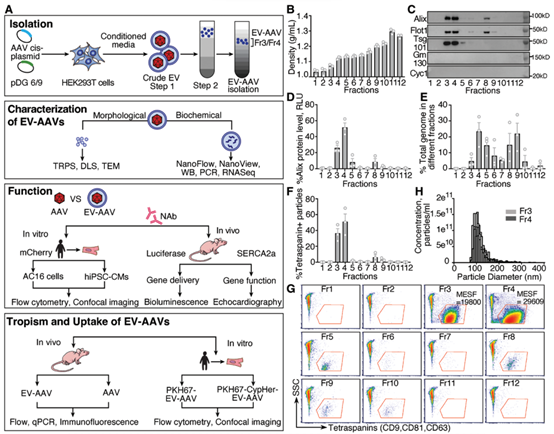
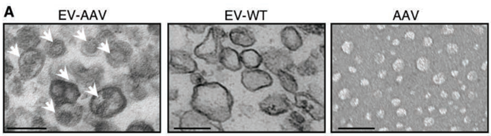
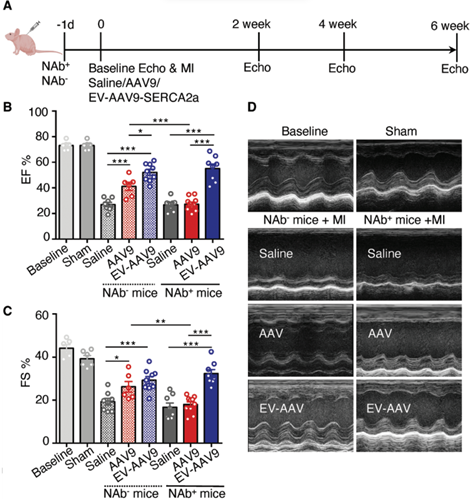
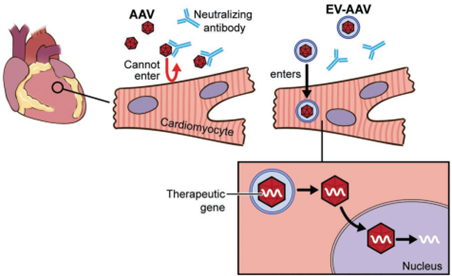
基因治疗是当前重要的生物医药研发方向,目前有超过40种疾病的治疗正在进行临床试验,已有多种基于病毒载体的药物已经获得了美国食品和药物管理局(FDA)的批准。基因治疗不仅用于罕见的单基因遗传性心肌病,还用于更常见的疾病,如糖尿病和心力衰竭。目前用于治疗心力衰竭的药物只能控制症状和疾病,但不能治愈。相比之下,基因治疗具有纠正潜在缺陷和病理以及介导心肌细胞(CM)功能长期改善的潜力。目前心肌基因转移的策略使用了由于其非致病性、稀有整合和长期高转基因表达水平而被广泛使用的腺相关病毒(AAV)。已经证明重组AAV血清型(称为AAV)在转导后大部分作为episomes存在约24个月,这表明AAV非常适合慢性心力衰竭治疗。虽然系统性地递送AAV以直接干预心脏细胞的遗传和分子基础的概念简单,但实现临床应用的道路是艰辛的。一个主要障碍是中和抗体(NAbs)的存在,这些抗体在自然暴露于AAV或AAV给药后形成。来自临床研究的数据表明,即使在相对低的滴度下,AAV NAbs也会阻止基因转导并减少或抵消治疗效果。针对AAV的NAbs随着年龄的增长而增加,并且似乎在所有研究人群中都很常见。患者中预先存在的AAV NAbs的高流行率阻碍了基于AAV的基因治疗的效率,并限制了符合基因治疗试验入组标准的患者数量。在最近一项关于AAV1 /肌浆网钙ATP酶2a(AAV1 / SERCA2a)基因治疗的临床研究中,发现在1552名心力衰竭患者中,59.5%的患者存在AAV1 NAbs。在另一项研究中,高剂量免疫抑制并未防止小型猪中AAV1 NAb的形成。由于患者可能需要> 1次病毒基因治疗处理,因此需要采取策略来规避NAbs。细胞外囊泡(EV)是膜结合囊泡,主动携带来自不同细胞类型的生物分子,例如脂质,蛋白质和RNA。最近的研究表明,EV可包含多种类型的病毒,包括肝炎,HIV和AAV,并保护这些病毒免受抗体介导的中和作用。通过载体EV保护的AAV(EV封装AAV [EV-AAV])是规避基于AAV的基因治疗中NAbs中和的有希望的方法。强大的EV膜可以保护AAV免受NAbs的影响,因此EV-AAV可以呈现更高的NAbs抵抗力。目前的研究表明,来自AAV产生HEK293T细胞的自然分泌的大型和小型EV可以在小鼠视网膜、内耳、肝脏和神经系统中携带并传递完整的AAV。自由AAV连同EV-AAV一起分泌到AAV生产细胞的调节培养基中。在EV-AAV制备中存在自由AAV可能会降低有效的EV-AAV剂量,降低它们的NAbs抵抗力,并导致更高水平的自由AAV引起不良反应。有效地从EV-AAV中去除自由AAV污染物是其临床转化的关键第一步。早期试图使用神经病毒型AAV血清型1、8和6纯化EV-AAV的尝试结果表明,其NAbs抵抗力有限,可能是由于与AAV或其不充分的分离有关。近日,国际顶尖心血管领域杂志Circulation上的一篇文章评估了与使用标准自由AAV载体相比,使用EV-AAV介导的基因转移到心脏的递送和治疗效果,无论是否有NAbs。该研究:(1)优化了基于超速离心的EV-AAV纯化策略,以从AAV生产的HEK293T细胞的调节培养基中分离高度纯净的EV-AAV,并最小化自由AAV污染;(2)全面表征了EV-AAV大小、纯度、浓度、形态、EV标记蛋白质的存在以及分子含量;(3)评估了EV-AAVs与标准自由AAV载体在人类左心室CM和人类诱导多能干细胞(hiPSC)衍生CM以及小鼠心脏中使用心肌病毒型AAV血清型6和9和几个报告构建物的基因递送效果和NAbs抵抗力;(4)验证了EV-AAV介导递送与AAV介导SERCA2a在预免疫小鼠心肌梗死(MI)预临床模型中递送的治疗效果;(5)在小鼠心脏内和人类CM体外研究了EV-AAV细胞内运输和心肌病毒机制。通过使用5种不同的体外和体内模型系统,该报道发现建立了一种新的基于AAV的心脏基因治疗临床转化策略。基于密度梯度超速离心的纯化工艺成功富集了EV-AAV在心肌梗死(MI)临床前小鼠模型中,在AAV中和抗体(NAb)存在的情况下,EV-AAV仍然能介导的SERCA2a基因递送,并显著改善心脏功能EV-WT和EV-AAV生产:顺序离心(步骤 1)
在转染质粒后的第三天,从HEK293T的细胞培养基中分离出EV-AAVs。为了分离EV-AAVs,进行了差速超速离心和碘二醇密度梯度。简而言之,通过500 g离心10分钟和2000 g离心20分钟去除细胞和细胞碎片。接下来,通过12000 g离心30分钟去除较大的细胞外囊泡(凋亡体和微囊泡)。12000 g离心的上清液在Optima L-90K超速离心机(Beckman Coulter)中使用Type 70Ti转子进行90分钟的120000 g离心。EV沉淀物在0.22 µm过滤的PBS中重悬。EV-WT和EV-AAV生产:碘克沙醇密度梯度离心(步骤 2)通过碘二醇梯度超速离心(一个碘二醇梯度包含5 mL 25%碘二醇、3 mL 40%和1 mL 60%碘二醇与3 mL EV样品)在SW41Ti转子(Beckman Coulter)中以190000 g离心3小时使用Ultra-clear离心管(Beckman Coulter)进行进一步的纯化步骤。离心后,从密度梯度顶部收集1 mL级分,并将每个级分在PBS中稀释10倍,并使用SW41Ti转子以120000 g离心90分钟,然后将所得沉淀物重悬于PBS中。使用Abbe折射计测定了每个分数的密度。所有离心均在4°C下进行。超速离心步骤提供的所有力值均表示平均相对离心力。使用与EV-AAVs相同的纯化过程从未转染的HEK293T细胞的细胞培养基中分离出野生型EVs(EV-WT)。细胞外囊泡/外泌体包裹AAV是当前产业界研发的重点方向之一(https://www.exosomemed.com/14499.html)。总的来说,该研究证实了EV-AAVs是完全具有感染性的,能够抵抗抗体介导的中和作用,并且能够有效地转导心肌。该研究提供了先进的策略,通过规避NAb中和作用来改善基因治疗,这是以前在该领域努力的障碍。这些发现为将基于AAV的心脏基因治疗临床转化以治疗更广泛的心力衰竭患者开辟了新途径。总之,该研究将对未来的基因治疗临床试验产生积极影响,并有可能推进目前基于AAV的治疗应用以治疗心血管疾病。Li X, La Salvia S, Liang Y, Adamiak M, Kohlbrenner E, Jeong D, Chepurko E, Ceholski D, Lopez-Gordo E, Yoon S, Mathiyalagan P, Agarwal N, Jha D, Lodha S, Daaboul G, Phan A, Raisinghani N, Zhang S, Zangi L, Gonzalez Kozlova E, Dubois N, Dogra N, Hajjar RJ, Sahoo S. Extracellular Vesicle-Encapsulated AAVs for Therapeutic Gene Delivery to the Heart. Circulation. 2023 Jul 6. doi: 10.1161/CIRCULATIONAHA.122.063759. PMID: 37409482.外泌体资讯网 Circulation:细胞外囊泡封装AAV将治疗性基因递送至心脏