MicroRNA(miRNA)作为一种基因表达的转录后调节因子,参与调控宿主细胞的多种功能。丁酸梭菌的胞外囊泡(Extracellular Vesicles,EV)调节肠道稳态并缓解小鼠结肠炎,但背后的机制尚未明确。近期,浙江省农业科学院肖英平团队研究发现丁酸梭菌来源的胞外囊泡通过调节肠道miRNA表达,改善肠道炎症,并提出了miRNA与肠道微生物的crosstalk参与了丁酸梭菌胞外囊泡介导的益生机制。相关研究成果以“Anti-Inflammatory Effect of Clostridium butyricum-Derived Extracellular Vesicles in Ulcerative Colitis: Impact on Host microRNAs Expressions and Gut Microbiome Profiles”为题在Molecular Nutrition and Food Research杂志上发表(DOI: 10.1002/mnfr.202200884),该文被选为同期杂志的封面文章。
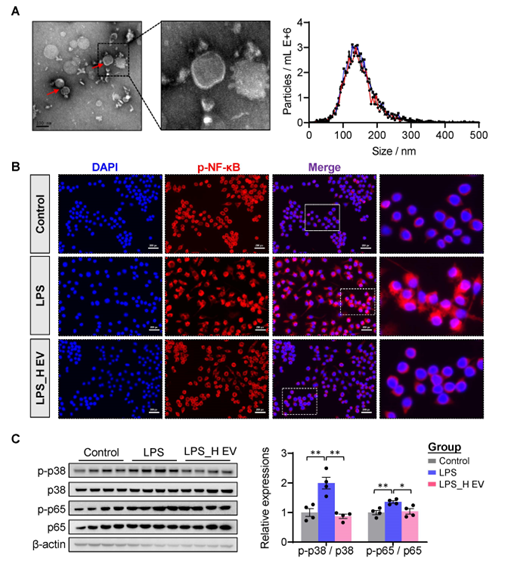
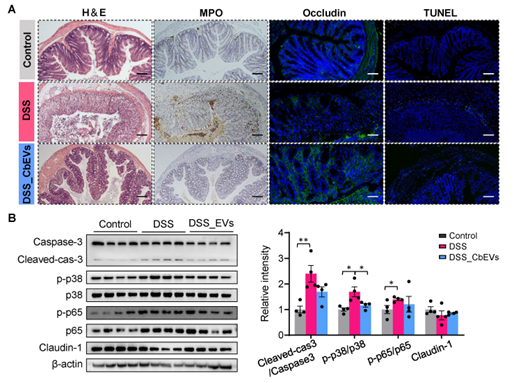
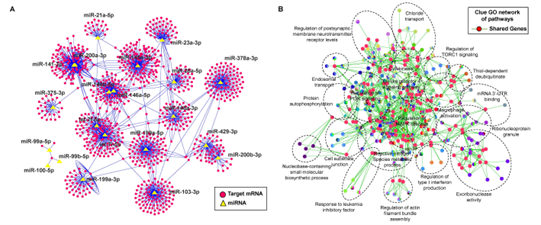
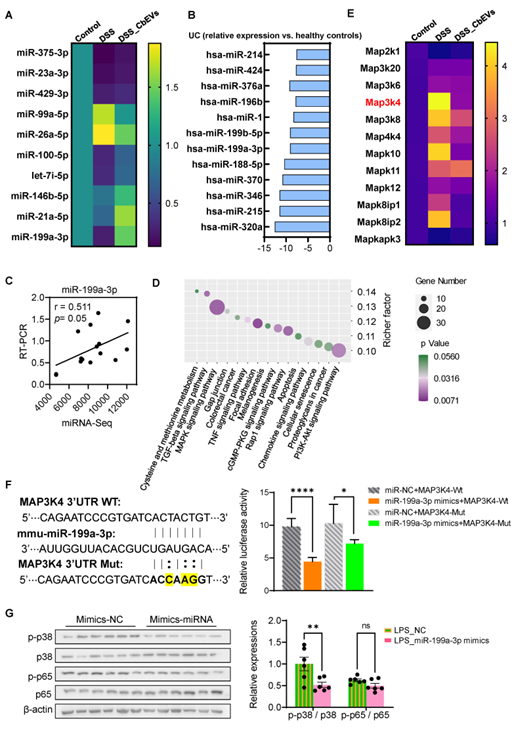
该研究利用超高速离心法获取丁酸梭菌分泌的EV,体外通过LPS诱导的巨噬细胞RAW264.7作为炎症研究模型,发现丁酸梭菌EV可有效抑制LPS诱导的巨噬细胞极化,抑制促炎信号通路MAPK/NF-κB的表达(图1)。其次,体内以DSS诱导的结肠炎小鼠为研究对象,通过Western blot结果证实丁酸梭菌胞外囊泡可以显著抑制小鼠肠道MAPK/NF-κB的表达,进而缓解肠道炎症,并在一定程度上减缓炎症诱导的细胞凋亡(图2)。进一步通过miRNA测序发现丁酸梭菌胞外囊泡可以调节肠道miRNA表达,且显著差异的miRNA其target mRNA功能主要聚焦在炎症相关信号通路上,如MAPK信号通路,Toll样受体信号通路,巨噬细胞极化等(图3)。图3 miRNA及其target mRNA功能主要聚焦在炎症相关信号通路随后,团队成员结合临床结肠炎患者与结肠炎小鼠肠道相关miRNA表达变化,聚焦到miR-199a-3p,并通过荧光报告基因实验进一步显示miR-199a-3p与Map3k4的3'UTR相互结合。体外巨噬细胞中RT-qPCR和Western blot结果证实miR-199a-3p可在转录水平抑制Map3k4表达,从而抑制促炎信号通路MAPK及NF-κB表达(图4)。图4 miR-199a-3p靶向Map3k4缓解小鼠肠道炎症此外,该研究还发现了丁酸梭菌胞外囊泡可以通过调节菌群色氨酸相关代谢产物,促进菌群代谢产生5-羟色氨酸 (5-HTP)、吲哚乳酸(ILA)和吲哚丙酸(IPA)等吲哚衍生物,进而促进肠上皮屏障功能并减轻小鼠肠道炎症(图5)。图5 丁酸梭菌胞外囊泡调节肠道菌群代谢色氨酸相关产物综上所述,该研究揭示了丁酸梭菌胞外囊泡抑炎作用的新机制,提出了miRNA在结肠炎发生发展中的潜在分子作用,为结肠炎等相关肠道疾病提供了新的思路和治疗策略。Anti-Inflammatory Effect of Clostridium butyricum-Derived Extracellular Vesicles in Ulcerative Colitis: Impact on Host microRNAs Expressions and Gut Microbiome Profiles, Mol Nutr Food Res. 2023 Jul;67(13): e2200884. doi: 10.1002/mnfr.202200884.外泌体资讯网 Mol Nutr Food Res封面文章|浙江省农业科学院肖英平:基于宿主miRNA及肠道菌群,揭示丁酸梭菌胞外囊泡的抑炎机制