外泌体是一类由细胞分泌的、直径约100 nm的囊泡,含有丰富的核酸、蛋白质、脂质等生物活性分子。近年来,外泌体被证实具有参与细胞间通讯、调节生理病理过程等功能,在疾病的发生发展过程中发挥着重要作用,已作为新兴的疾病诊断标志物和疾病治疗药物。从复杂的生物体系中高特异性、低损伤地分离外泌体是下游检测和治疗等生物应用的重要基础。DNA适配体是一类具有分子识别能力的DNA单链,可以与外泌体表面的靶标分子特异性地结合,在外泌体分离方面极具应用潜力。利用DNA的序列可编程性和适配体的分子识别功能,开发外泌体识别分离新方法,实现对外泌体的高特异性、低损伤分离,有望推动外泌体在生物医学领域的发展和应用。近期,天津大学化工学院仰大勇教授团队在DNA功能材料用于生物颗粒分离和应用方面取得新进展,团队设计了基于多聚核酸适配体的DNA水凝胶,实现了复杂生物体系中外泌体的高特异性和低损伤分离,应用于临床乳腺癌患者血清样本中外泌体microRNA的检测和大鼠心肌梗死模型的有效治疗,相关成果以“A DNA-based hydrogel for exosome separation and biomedical applications”为题发表在Proceedings of the National Academy of Sciences of the United States of America(美国科学院院刊)上(2023 Jul 11;120(28):e2303822120)。仰大勇教授和姚池副教授为共同通讯作者,博士生唐建普、硕士生贾雪梅和硕士生李倩为共同第一作者。该工作得到国家自然科学基金等资助支持。
仰大勇教授团队开发了一种基于多聚适配体DNA网络的外泌体分离策略,实现了复杂生物体系中(血清、培养基等)外泌体的高特异性和低损伤分离。该策略通过酶促滚环扩增反应合成含有多聚适配体的DNA超长单链,将DNA单链加入生物体系中,含有多聚适配体的DNA链能够通过特异性识别外泌体上CD63蛋白实现外泌体捕获。随后,加入另一条DNA超长单链,两条DNA单链通过碱基互补杂交形成交联网络,DNA网络将捕获的外泌体包封在网络中,实现将外泌体从液态样品分离至固态网络水凝胶中。外泌体的可控释放可以由两种方法实现:1)酶降解法,利用脱氧核糖核酸酶降解DNA网络实现外泌体的释放;2)链置换法,引入与DNA网络亲和力更高的置换链,在不破坏网络的情况下实现外泌体的释放。结果表明,通过这两种方法释放的外泌体均保持了良好的结构和成分完整性。在此基础上,开发了分离-检测一体化的方法,将分子信标和信号探针整合在DNA网络中,在分离外泌体的同时检测外泌体内部靶标microRNA-21,实现了乳腺癌临床样本和健康供体样本的精准区分。另一方面,该网络系统还可以应用于分离-治疗一体化,将捕获有间充质干细胞来源外泌体的DNA网络水凝胶注射到心肌梗死模型大鼠的胸腔内,实现了大鼠心肌修复和心脏功能的有效改善。这项工作针对外泌体生物应用的难题,构建了功能DNA网络水凝胶,实现了复杂生物体系中外泌体的分离,并探索了在重大疾病诊断和治疗等生物医用领域的应用潜力。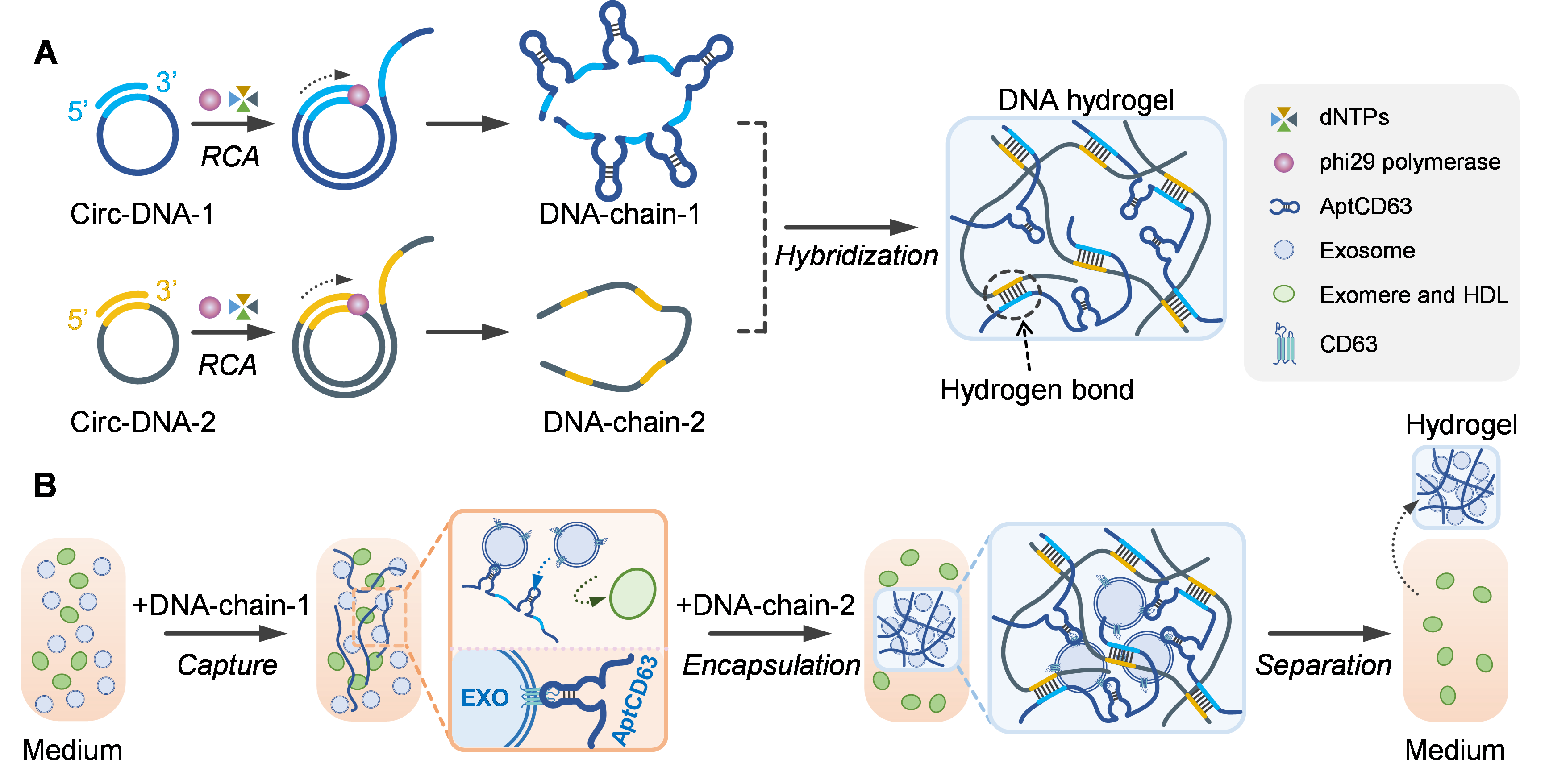 图1. 基于多聚DNA适配体的水凝胶用于外泌体分离的示意图A DNA-based hydrogel for exosome separation and biomedical applications, Proc Natl Acad Sci U S A.2023 Jul 11;120(28):e2303822120. doi: 10.1073/pnas.2303822120. Epub 2023 Jul 3.
图1. 基于多聚DNA适配体的水凝胶用于外泌体分离的示意图A DNA-based hydrogel for exosome separation and biomedical applications, Proc Natl Acad Sci U S A.2023 Jul 11;120(28):e2303822120. doi: 10.1073/pnas.2303822120. Epub 2023 Jul 3.外泌体资讯网 PNAS | 天津大学化工学院仰大勇团队:DNA水凝胶分离外泌体,应用于重大疾病检测和治疗
 图1. 基于多聚DNA适配体的水凝胶用于外泌体分离的示意图
图1. 基于多聚DNA适配体的水凝胶用于外泌体分离的示意图 图1. 基于多聚DNA适配体的水凝胶用于外泌体分离的示意图
图1. 基于多聚DNA适配体的水凝胶用于外泌体分离的示意图




