细胞外囊泡(EVs)由所有活细胞分泌,存在于许多体液中,发挥着许多生理和病理功能。由于其安全性和固有的生物活性,EV已成为多功能治疗剂、生物标志物和潜在的药物载体。尽管人们对EV的兴趣日益浓厚,但目前该领域的进展在一定程度上受到相对低效的EV分离技术的限制。来自瑞士苏黎世联邦理工学院的研究人员开发了一种“一体化”的电化学控制装置,用于EV的捕获、装载和释放,利用该装置从健康小鼠和糖尿病小鼠的皮肤伤口中成功分离了EV,并证明其在核酸药物递送中的潜在应用。相关内容以“Ultra-fast And Controlled Capturing, Loading, And Release of Extracellular Vesicles by A Portable Microstructured Electrochemical Fluidic Device”为题于7月15日在线发表在国际先进材料化学期刊Advanced Materials杂志上。
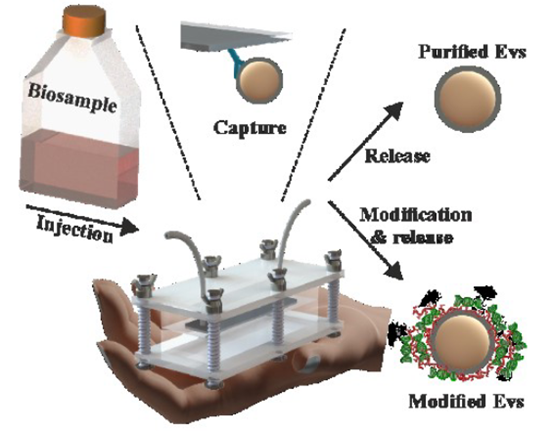
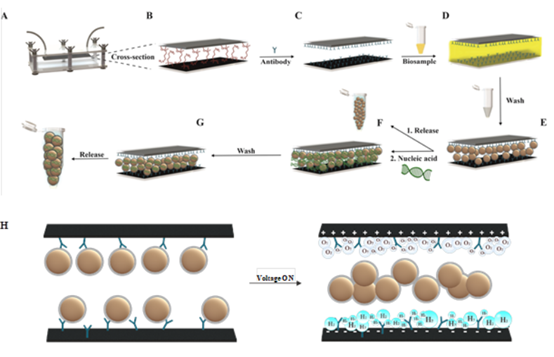
细胞外囊泡(Extracellular vesicles,EVs)是一种自然产生的囊泡,由所有细胞类型分泌,存在于许多体液中,包括血浆、尿液、唾液、淋巴液、母乳和组织培养上清。根据国际细胞外囊泡学会(International Society for Extracellular Vesicles,ISEV)的定义,EVs是指一种大小在30至1000 nm以上的异质粒子群,包括外泌体、微囊泡和凋亡小体。与质膜类似,EV的膜由磷脂双分子层组成,富含CD9和CD63等四次跨膜蛋白。EV通过向受体细胞传递核酸、蛋白质、脂质和小分子,积极参与细胞间通讯。除了细胞信号传导外,EV还参与多种生物过程,如免疫刺激、发育调节和能量代谢控制。因此,EV被研究为生物再生剂和细胞治疗的潜在替代品。美国国立卫生研究院(NIH)临床试验网站注册了至少120项涉及EV的临床试验,其中23项已经完成。此外,EVs还参与了许多病理过程,如糖尿病、神经变性疾病和癌症,部分机制是通过“传播”病理性信使而导致疾病发展。因此,EV正在成为有前景的生物标志物。基于EV的液体活检检测已经开始了商业化。然而,尽管人们对开发用于治疗和诊断的EV越来越感兴趣,但低效率的EV分离技术在一定程度上阻碍了这一领域的进展。EV分离过程的主要障碍通常是它们在来源生物流体中的低丰度。此外,EV的异质性进一步复杂化了它们的纯化流程。常见的EV分离方法,如离心、过滤和粒径排阻色谱,涉及多个耗时的步骤,缺乏选择性,可能保留杂质,并且需要专门的实验室设备。排除体积的聚合物可以沉淀EV,然而,该方法也会浓缩污染物质导致EV纯度不足。更有选择性的分离方法是基于EV与特定抗体的高亲和力结合来捕获EV。例如,一些商业试剂盒依赖于涂有针对常见EVs表面分子的抗体的磁珠。另一种方法采用基于纸基抗体修饰平台。尽管这些方法具有高特异性,但它们的容量较低,这限制了它们的产率。商业上可用的亲和柱可以覆盖针对EV表面分子的抗体,以提高产量。然而,这种方法仍然需要较长的准备时间和缓冲区交换。近年来,基于微流体的技术已经成为快速和低成本的EV分离替代方案。此前发表的研究已经设计了一个人字形芯片来增加EV与抗体的相互作用,抗体被涂覆在微流控通道表面。动态微流控策略利用了EV在外力作用下的独特运动,例如电压。这些装置可以与过滤或免疫亲和捕获相结合。然而,EV迁移所需的高电压和生理液体的电荷筛选效应限制了通道的大小,从而限制了输出。另一种方法是设计一种声流平台来直接从血液中分离EV,然而,这种方法的体积很小,并且需要光刻机和洁净室设施来制造。总之,尽管最近微流体和其他新兴技术(如基于亲和力的平台)提供了改进,但目前可用的设备存在局限性,例如样品处理能力低,适用性窄,与下游治疗应用的集成有限。为了克服从天然生理流体中分离EV的各种挑战,研究人员设计了一种最先进的电化学控制捕获和释放流体装置。这项工作描述了一种电化学控制的“一体化”设备,可以捕获、装载和释放EV。该装置由限制在抗体涂层微结构电极内的流体通道组成,能从尿液和血清等多种生物体液中快速分离出高纯度的EV。EV通过亲和相互作用固定在装置上,并通过施加电压可控地释放。与传统的EV分离方法相比,特别是与其他基于免疫亲和、电化学和微流体的设备相比,所开发的设备可以在更短的时间内以低成本和高纯度处理更大样本量的各种生理液体。微流控通道壁由纤维材料组成,可增加功能化的活性表面积,同时实现更快的流速以获得最佳产量。样品处理、试剂混合、分离和检测流程都被简化了。研究人员利用该装置,从健康小鼠和糖尿病小鼠的各种生物体液以及受伤皮肤组织中提取EV,揭示了两种小鼠之间蛋白质组成的差异。研究发现,与健康小鼠相比,来自糖尿病小鼠伤口愈合的EV富含线粒体蛋白。最后,研究证明了该装置可以用于纯化装载核酸的EV,并去除多余的和潜在有毒的转染剂。该设备提供了一种“一体化”的芯片实验室方法,能够以简单有效的方式直接从生物流体中分离EV,同时还可以进行后续试验操作。
参考文献:Ultra-fast And Controlled Capturing, Loading, And Release of Extracellular Vesicles by A Portable Microstructured Electrochemical Fluidic Device. Adv Mater. 2023 Jul 15:e2212000.




