细胞外囊泡(Extracellular Vesicles,EVs)是由各种类型细胞分泌包含双层膜的微小结构,在几乎所有生物体中都存在。EVs可携带一系列生物活性分子,包括蛋白质、核酸、脂质和代谢物等,这些活性分子可通过受体介导的内吞、巨胞饮以及膜融合等方式递送到其受体细胞内。有报道发现EVs中包含的某些分子,如细胞因子、生长因子和代谢物等可作用于细胞表面靶点或在细胞外环境中直接发挥其生物学活性,但这些活性分子释放到细胞外环境的具体机制尚不清楚。
孔道形成蛋白(pore-forming proteins, PFPs)是一类以水溶性单体形式分泌,并广泛分布于各种生物体中的一类非经典膜蛋白。当PFPs与靶细胞结合时,这类蛋白质发生寡聚化并形成大小不同(1-30纳米)的跨膜孔结构,该跨膜结构可作为通道传递各种分子。例如,执行细胞凋亡的gasdermin D可在细胞内膜寡聚化并形成细胞膜通道,从而促进细胞质内容物如白细胞介素-1β释放到细胞外环境。
近日,昆明动物研究所张云和南昌大学向阳团队在前期对两栖动物大蹼铃蟾(Bombina maxima)孔道形成蛋白βγ-CAT的功能研究基础上,联合在Zoological Research 上发表题为“Amphibian pore-forming protein βγ-CAT drives metabolite release from small extracellular vesicles through channel formation”的研究论文(doi: 10.24272/j.issn.2095-8137.2022.510)。
该研究以大蹼铃蟾为研究模型,首先通过免疫荧光和免疫电镜发现βγ-CAT在大蹼铃蟾皮肤组织中与EVs有明显的共定位,提示该蛋白可能与EVs的生理功能有直接作用。进一步对大蹼铃蟾皮肤成纤维细胞进行体外培养,成功地从其培养上清液中分离出小EVs,并通过纳米颗粒跟踪分析、免疫印迹和透射电镜对这些小EVs进行了鉴定。然后通过体外直接孵育结合免疫印迹实验发现βγ-CAT可在分离的小EVs上形成明显的寡聚体,透射电镜观察发现这种作用不会破坏小EVs的膜结构。这些结果提示βγ-CAT可直接在小EVs上形成通道,从而帮助EVs中的活性分子释放。前期研究发现βγ-CAT在膜系统中可形成孔径约为1.5 纳米的通道,因此研究人员将目标聚焦于代谢物。通过对βγ-CAT和小EV孵育后的上清收集并进行代谢组学的测定,研究人员在βγ-CAT处理小EV后的上清中共鉴定到92个差异代谢物。KEGG分析发现这些代谢物主要富集在嘌呤代谢、 泛酸和辅酶A生物合成、赖氨酸降解、精氨酸和脯氨酸代谢以及嘧啶代谢上。这些发现进一步证实了先前的假设,即βγ-CAT可直接作用于EVs,并充当了EVs内容物分泌通道的功能。
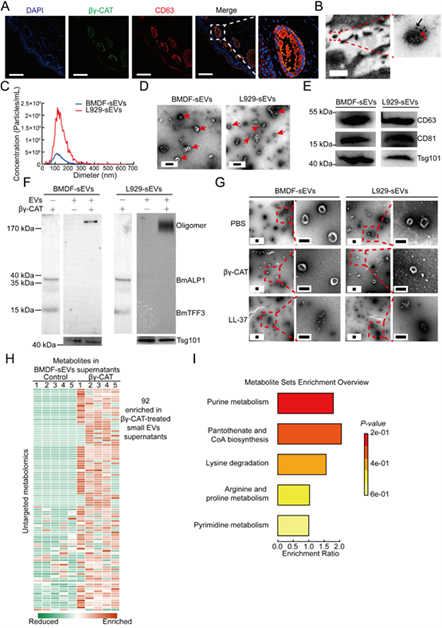
张云研究员团队在前期研究中,根据βγ-CAT的调控网络及细胞作用通路,提出了分泌型内吞溶酶体通道(Secretory endolysosome channels, SELCs)及其相关细胞通路(SELCs通路)的创新型概念。βγ-CAT代表了新型孔道形成蛋白驱动的细胞输送和转运系统。在大蹼铃蟾中发挥着多种生理功能,包括皮肤水平衡和呼吸,营养吸收和转运,以及免疫防御等。该项研究也从另一个方面表明βγ-CAT作为生理元件在大蹼铃蟾皮肤中通过作用于EVs的形式发挥调控代谢的功能。
参考文献:
Amphibian pore-forming protein βγ-CAT drives metabolite release from small extracellular vesicles through channel formation. Zool Res. 2023, 44(4): 739-742. doi: 10.24272/j.issn.2095-8137.2022.510.
Animal secretory endolysosome channel discovery. Zool Res. 2021, 42(2):141-152. doi: 10.24272/j.issn.2095-8137.2020.358.
外泌体资讯网 Zool Res|昆明动物研究所张云/南昌大学向阳团队:两栖动物孔道形成蛋白βγ-CAT通过形成通道驱动小细胞外囊泡代谢物释放





