近期,四川大学国家生物医学材料工程技术研究中心/生物医学工程学院张兴栋院士团队、王启光副研究员/樊渝江教授提出了一种利用脐带来源间充质干细胞衍生外泌体(UCMSC-EXOs)的无细胞治疗骨关节炎新策略。研究人员利用软骨细胞靶向聚合物修饰外泌体,并封装在巯基化透明质酸微凝胶中,形成“两相”释放系统,协同促进大鼠模型中OA软骨的修复。这项研究强调了UCMSC-EXOs对OA软骨细胞再年轻化的作用,并发现UCMSC-EXO中的p53信号通路是恢复老化软骨细胞的关键因素。软骨细胞靶向和缓释策略相结合,有效提升了外泌体的体内保留时间和作用效率。该工作以“Cell-Free Osteoarthritis Treatment with Sustained-Release of Chondrocyte-Targeting Exosomes from Umbilical Cord-Derived Mesenchymal Stem Cells to Rejuvenate Ageing Chondrocytes”为题发表在ACS Nano上(doi: 10.1021/acsnano.3c01612)。文章第一作者是四川大学生物医学工程学院博士生曹洪芙。该研究得到国家自然科学基金委的支持。
图1. 可持续释放的软骨细胞靶向UCMSC-EXO的治疗示意图
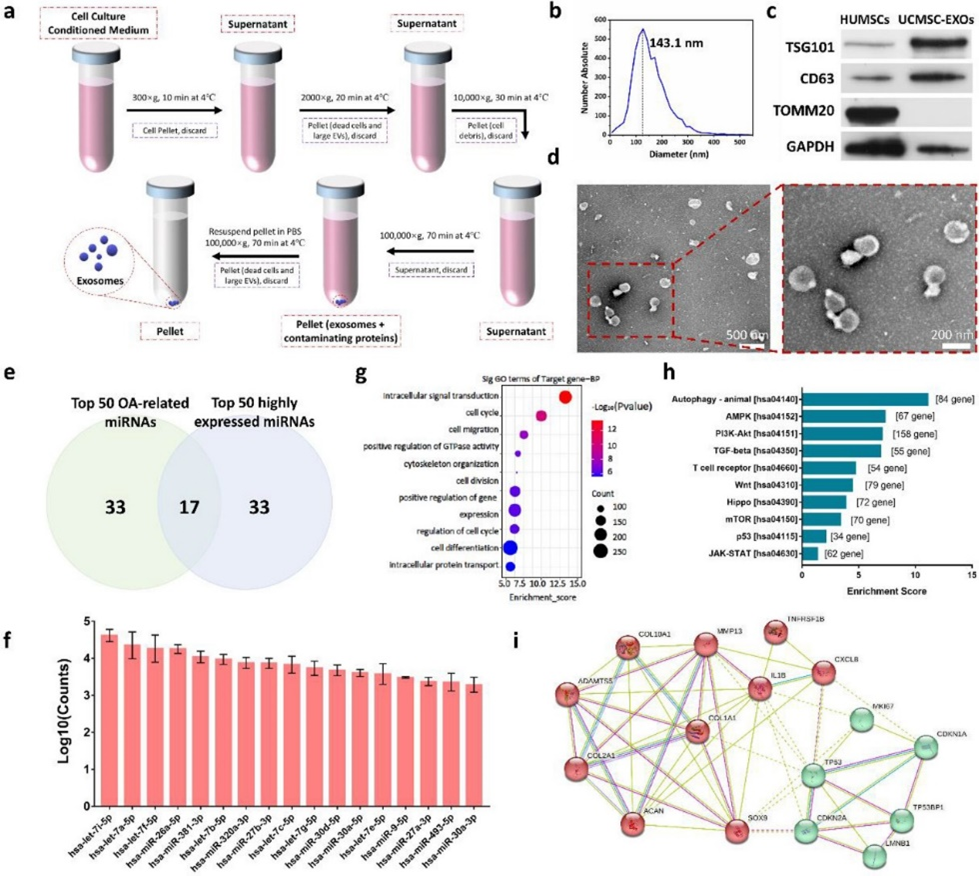
该研究证实,UCMSC-EXOs中高表达的功能性miRNA与OA相关,并结合对应的靶基因分析确认p53信号通路为恢复OA软骨细胞功能的关键因子(图2)。在此基础上,通过体外细胞实验验证了UCMSC-EXOs对OA软骨细胞的再年轻化和细胞外基质再生的作用(图3)。
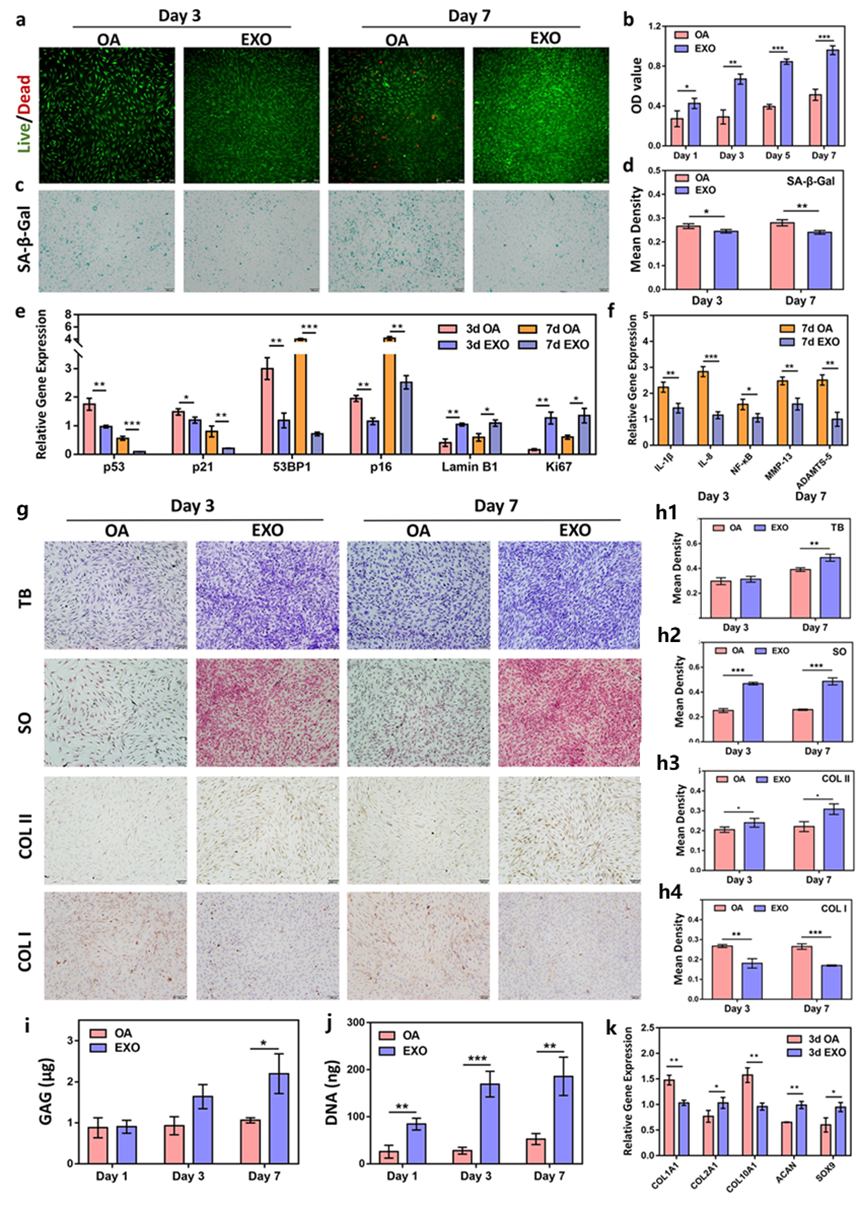 图3. UCMSC-EXOs在老化OA软骨细胞的年轻化及功能重塑中的作用
图3. UCMSC-EXOs在老化OA软骨细胞的年轻化及功能重塑中的作用
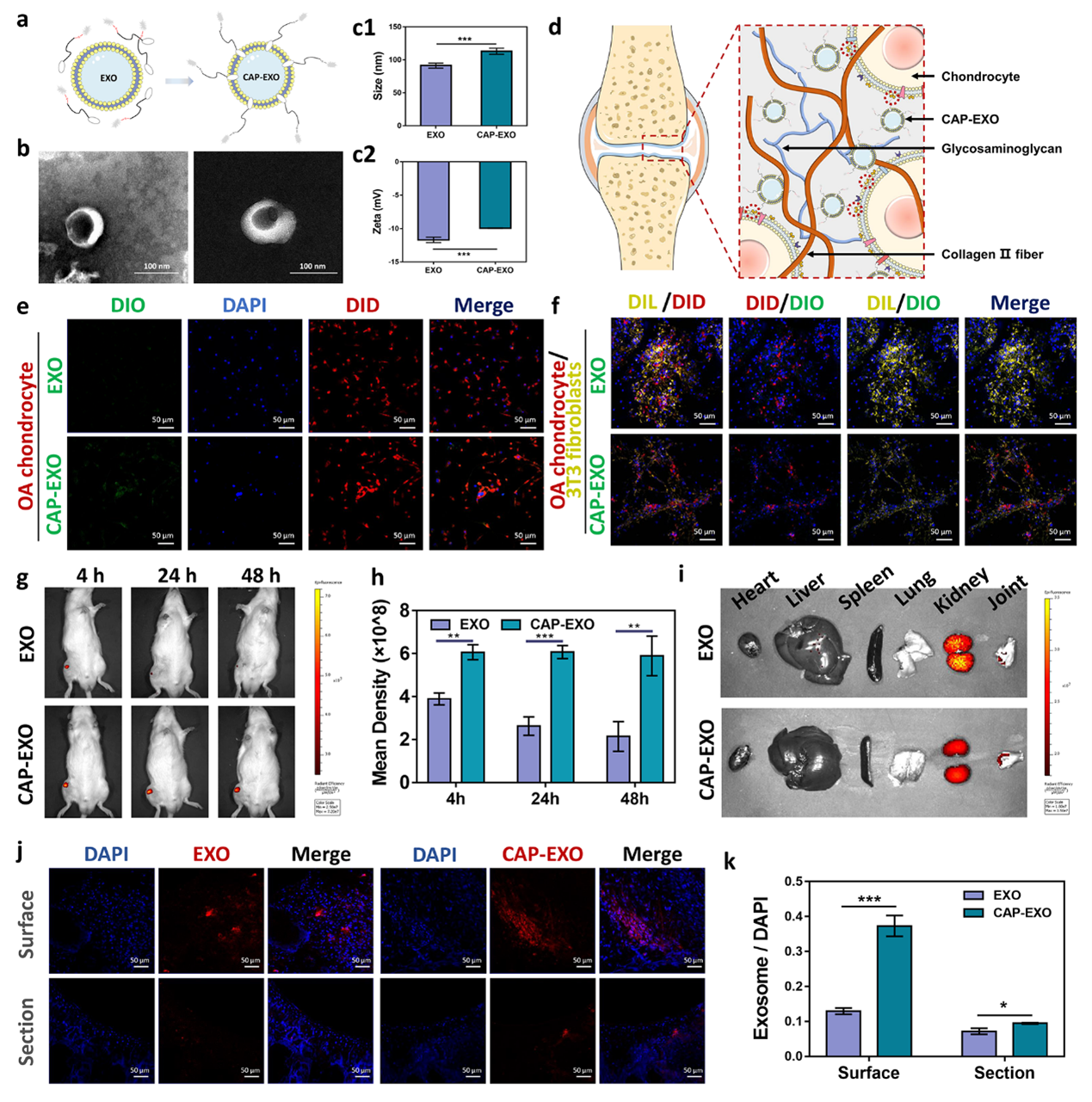
为了提高体内的治疗效率,该研究采用CLS-PEG-CAP高分子对外泌体表面进行了软骨细胞靶向肽(CAP)修饰,显著提高了软骨病变部位UCMSC-EXOs的富集,并减少了在其它器官中的扩散(图4)。
研究人员进一步利用巯基化透明质酸(HA-SH)微凝胶通过二硫键/共混双重机制封装外泌体,构建“两相”释放系统(图5),在关节腔内实现外泌体14天以上的持续释放。该体系中存在的部分未与HA-SH材料结合的外泌体首先快速释放,在关节软骨表面富集“先头兵”;而通过二硫键与HA-SH结合的外泌体随着降解逐步释放。
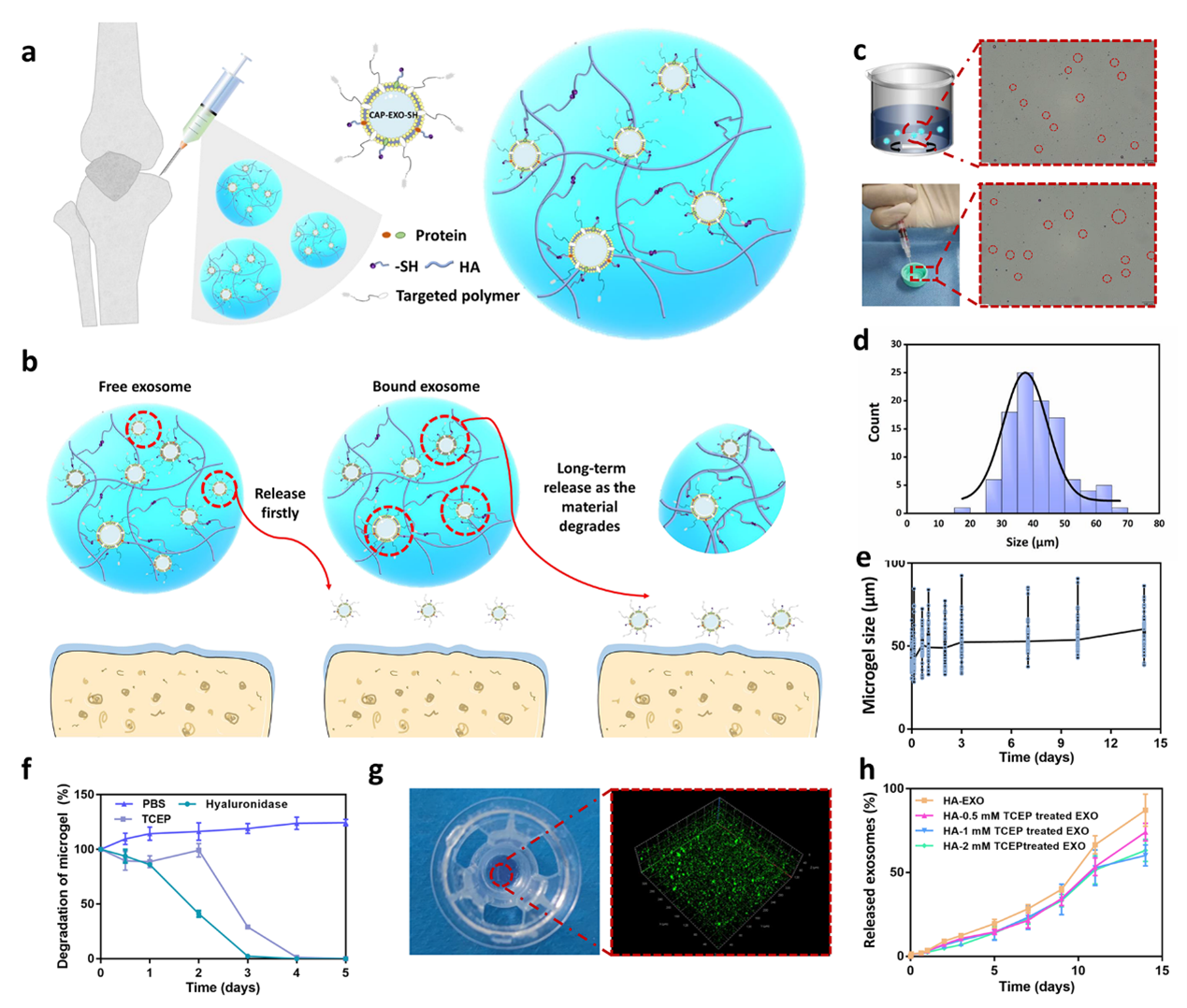 图5. 可注射HA-SH微凝胶中外泌体的“两相”缓释
图5. 可注射HA-SH微凝胶中外泌体的“两相”缓释
体内实验结果表明,利用工程化手段赋予UCMSC-EXOs的软骨细胞特异性靶向和体内缓释功能在OA治疗中显示出良好协同效应,其治疗效果显著优于天然外泌体和仅具有特异性靶向或体内缓释作用的外泌体对照组(图6)。
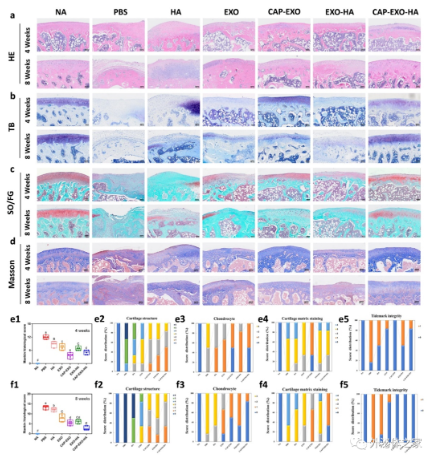 图6. 具有软骨细胞特异性靶向和体内缓释功能的外泌体显示出良好的OA治疗效果
图6. 具有软骨细胞特异性靶向和体内缓释功能的外泌体显示出良好的OA治疗效果
该工作是团队近期对工程化外泌体平台构建的最新进展之一。通过软骨特异性靶向和HA-SH微凝胶负载缓释的工程化UCMSC-EXOs可以显著提高其在关节部位恢复衰老软骨细胞功能的效率和有效时间,在OA治疗中具有良好的临床应用前景。
参考文献:
Cell-Free Osteoarthritis Treatment with Sustained-Release of Chondrocyte-Targeting Exosomes from Umbilical Cord-Derived Mesenchymal Stem Cells to Rejuvenate Aging Chondrocytes, ACS Nano. 2023 Jul 13. doi: 10.1021/acsnano.3c01612.