糖尿病足(diabetic foot ulcers, DFUs)的高截肢率和高死亡率给患者和社会带来了沉重的负担。加速创面愈合被认为是减少DFUs截肢的关键。
近日,重庆大学附属中心医院邓武权教授团队研究生陈天怡和宋佩阳在Burns&Trauma杂志在线发表题为“Sphingosine-1-phosphate derived from PRP-Exos promotes angiogenesis in diabetic wound healing via the S1PR1/AKT/FN1 signalling pathway”的研究成果(2023 May 23;11:tkad003),结果证实磷酸鞘氨醇-1(sphingosine-1-phosphate, S1P)高富集于富血小板血浆源性外泌体(exosomes derived from platelet-rich plasm, PRP-Exos)。在高糖环境下,PRP-Exos可通过结合皮肤组织血管内皮细胞膜上的磷酸鞘氨醇-1受体1(S1P receptor 1, S1PR1),传递S1P信号,激活AKT/FN1通路,从而发挥促血管新生与促创面修复的作用。
邓武权教授团队长期致力于PRP及其衍生物的临床治疗和机制探讨,成果发表在Signal Transduct Target Ther、Cell Transplant、Infect Drug Resist、Front Bioeng Biotechnol等。但是受限于自体PRP来源有限、异体PRP存在可能的免疫反应,以及PRP本身不具备靶向作用等,PRP治疗有待进一步优化。近年来,PRP-Exos在组织再生领域引起了广泛的关注。由于PRP-Exos具备低免疫原性、跨器官通讯能力以及靶向修复等优势,是PRP疗法的优化替代方案。
该研究通过透射电镜、纳米流式示踪以及Western blotting对PRP-Exos进行了特异性鉴定。随后开展了PRP-Exos干预糖尿病小鼠创面的研究(图1),证实PRP-Exos显著地促进了糖尿病小鼠创面闭合率(P<0.01)。H&E染色的结果表明,PRP-Exos显著促进糖尿病小鼠创面再上皮化程度(P<0.01)。通过对创缘组织中的血管内皮细胞标志物CD31进行免疫荧光染色,证实PRP-Exos显著地促进了CD31的免疫荧光强度(P<0.05)。因此,PRP-Exos被认为可显著地发挥促创面修复的效应。
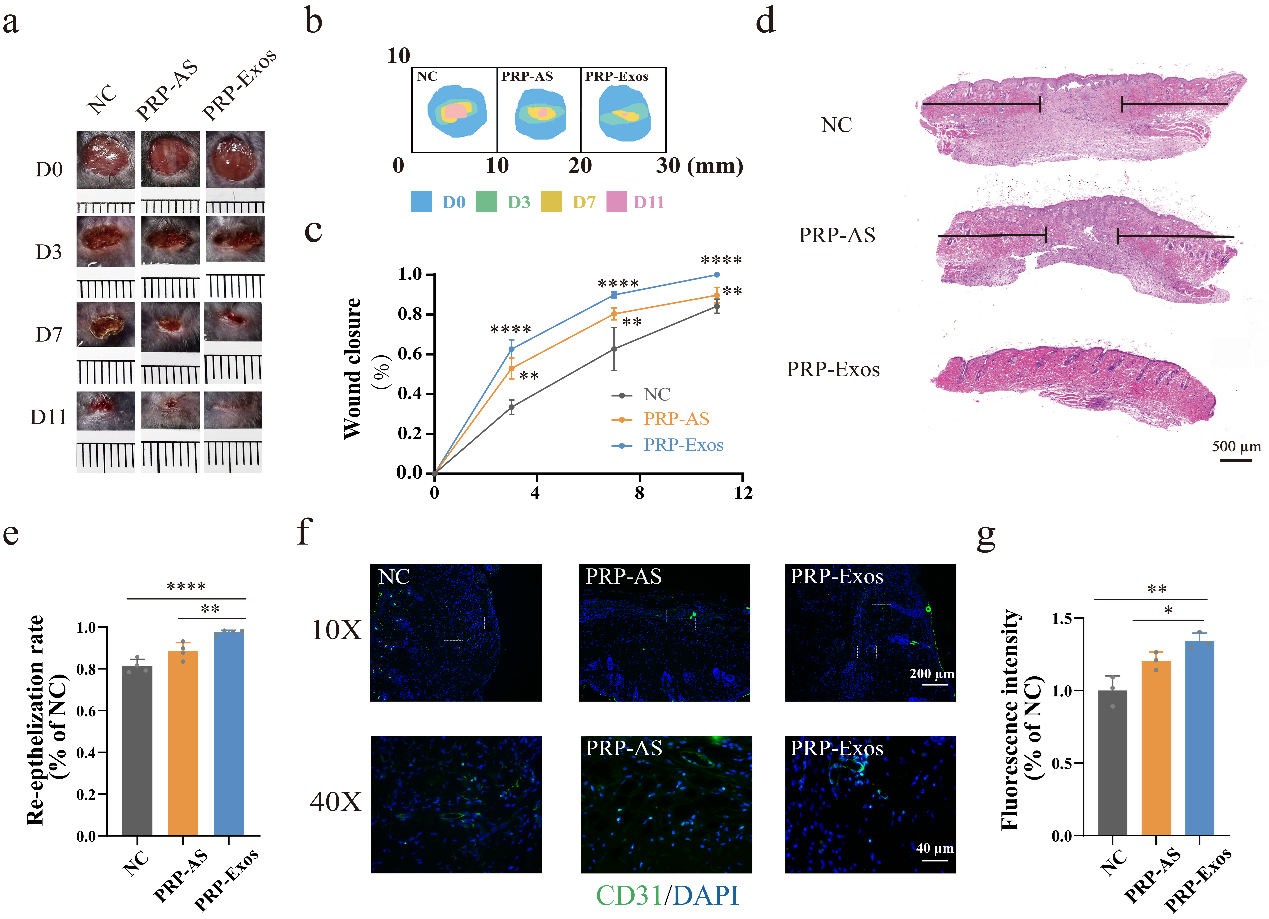 图1.(a-b)对糖尿病小鼠创缘部位进行NC、PRP-AS以及PRP-Exos干预后,绘制了具有代表性的创面闭合大体图以及模式图(n=5)。(c)通过对创面闭合率进行统计学分析,比较PRP-Exos与PRP-AS,以及PRP-Exos与NC之间的差异情况。(d-e)H&E染色及其统计学分析。(f-g)对血管内皮标志物CD31进行免疫荧光染色。****P < 0.0001, ***P < 0.001, **P < 0.01, *P < 0.05。
图1.(a-b)对糖尿病小鼠创缘部位进行NC、PRP-AS以及PRP-Exos干预后,绘制了具有代表性的创面闭合大体图以及模式图(n=5)。(c)通过对创面闭合率进行统计学分析,比较PRP-Exos与PRP-AS,以及PRP-Exos与NC之间的差异情况。(d-e)H&E染色及其统计学分析。(f-g)对血管内皮标志物CD31进行免疫荧光染色。****P < 0.0001, ***P < 0.001, **P < 0.01, *P < 0.05。
随后,作者开展了PRP-Exos干预人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)的体外研究(图2)。首先,通过外泌体吞噬实验证实,被PKH26标记的PRP-Exos,在六小时内通过胞吞作用进入到HUVECs胞内。通过CCK-8实验探索PRP-Exos干预HUVECs的结果表明,在高糖环境下,PRP-Exos处理HUVECs的最适作用时间是18小时。在确定PRP-Exos处理HUVECs的最适作用时间节点后,通过CCK-8、EdU增殖、流式细胞术检测细胞周期等证实,PRP-Exos可显著促进HUVECs的增殖能力(P<0.05);通过transwell、活细胞工作站观察细胞划痕等实验证实,PRP-Exos可显著促进HUVECs的迁移能力(P<0.0001);通过成管实验证实,PRP-Exos可显著促进HUVECs的管形形成能力(P<0.0001)。
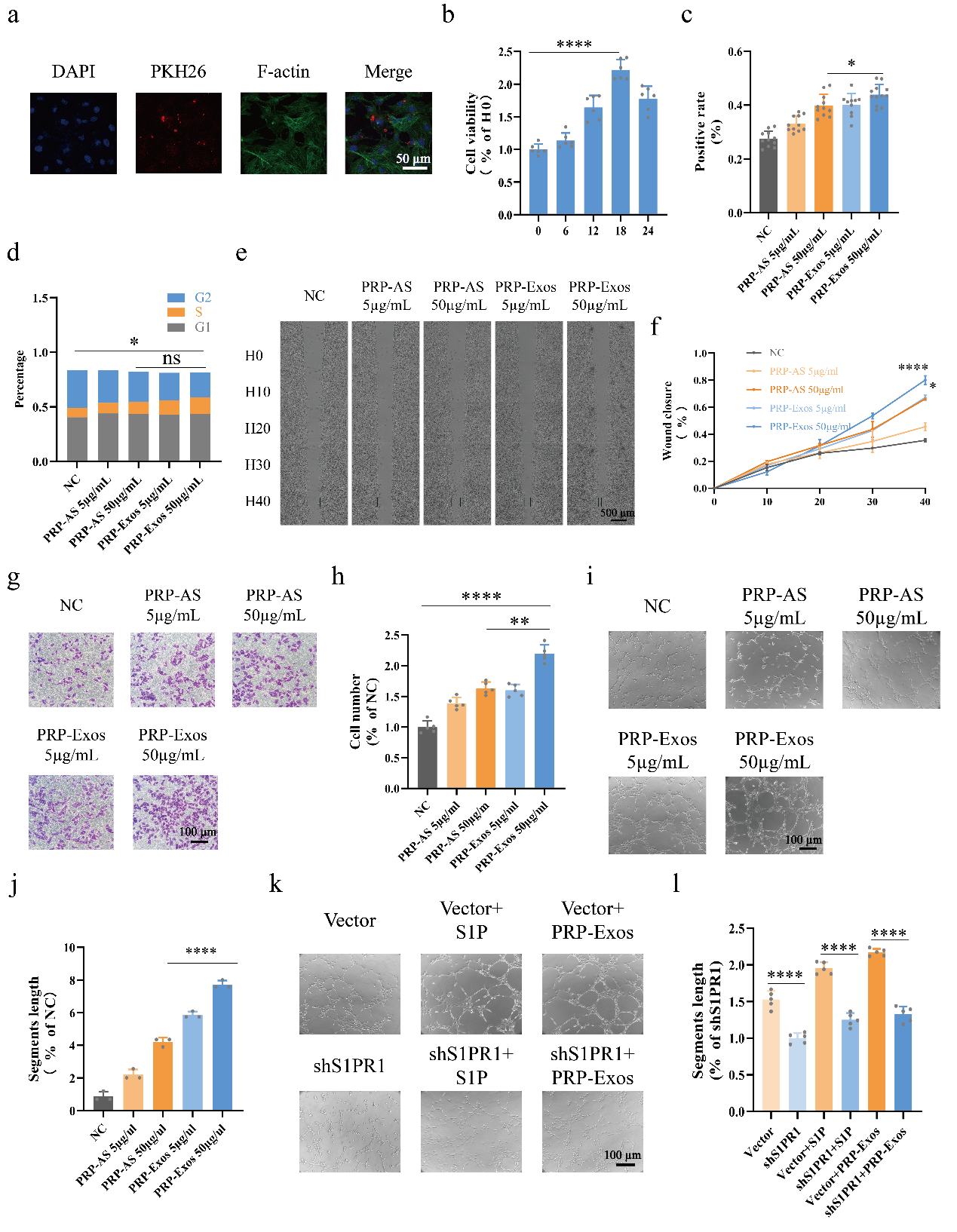 图2.(a)外泌体吞噬实验。(b)CCK-8实验用来探索PRP-Exos处理HUVECs的最适时间。(c)EdU实验用来检测PRP-Exos处理HUVECs后的增殖情况。(d)CCK-8实验用来检测PRP-Exos处理HUVECs后的细胞活力情况。(e)通过流式细胞仪,检测PRP-Exos处理HUVECs后的细胞周期情况。(f-g)通过活细胞工作站连续观察PRP-Exos干预HUVECs后的迁移情况。(h-i)Transwell实验用来检测HUVECs的迁移能力。(j-k)血管形成实验用来检测PRP-Exos处理HUVECs后的管形形成情况。(l-m)血管形成实验用来检测shS1PR1、PRP-Exos、S1P等处理HUVECs后的管形形成情况。****P < 0.0001, ***P < 0.001, **P < 0.01, *P < 0.05,ns表示没有显著性差异。
图2.(a)外泌体吞噬实验。(b)CCK-8实验用来探索PRP-Exos处理HUVECs的最适时间。(c)EdU实验用来检测PRP-Exos处理HUVECs后的增殖情况。(d)CCK-8实验用来检测PRP-Exos处理HUVECs后的细胞活力情况。(e)通过流式细胞仪,检测PRP-Exos处理HUVECs后的细胞周期情况。(f-g)通过活细胞工作站连续观察PRP-Exos干预HUVECs后的迁移情况。(h-i)Transwell实验用来检测HUVECs的迁移能力。(j-k)血管形成实验用来检测PRP-Exos处理HUVECs后的管形形成情况。(l-m)血管形成实验用来检测shS1PR1、PRP-Exos、S1P等处理HUVECs后的管形形成情况。****P < 0.0001, ***P < 0.001, **P < 0.01, *P < 0.05,ns表示没有显著性差异。
通过ELISA实验检测PRP-Exos以及其对照组PRP-AS中S1P的含量,证实S1P主要富集在PRP-Exos中。并且,RT-qPCR的结果证实,S1PR1的表达量在糖尿病患者和动物皮肤组织中显著升高(图3)。作为高糖环境下S1P信号结合的主要受体,S1PR1被认为起到了关键的调节作用。
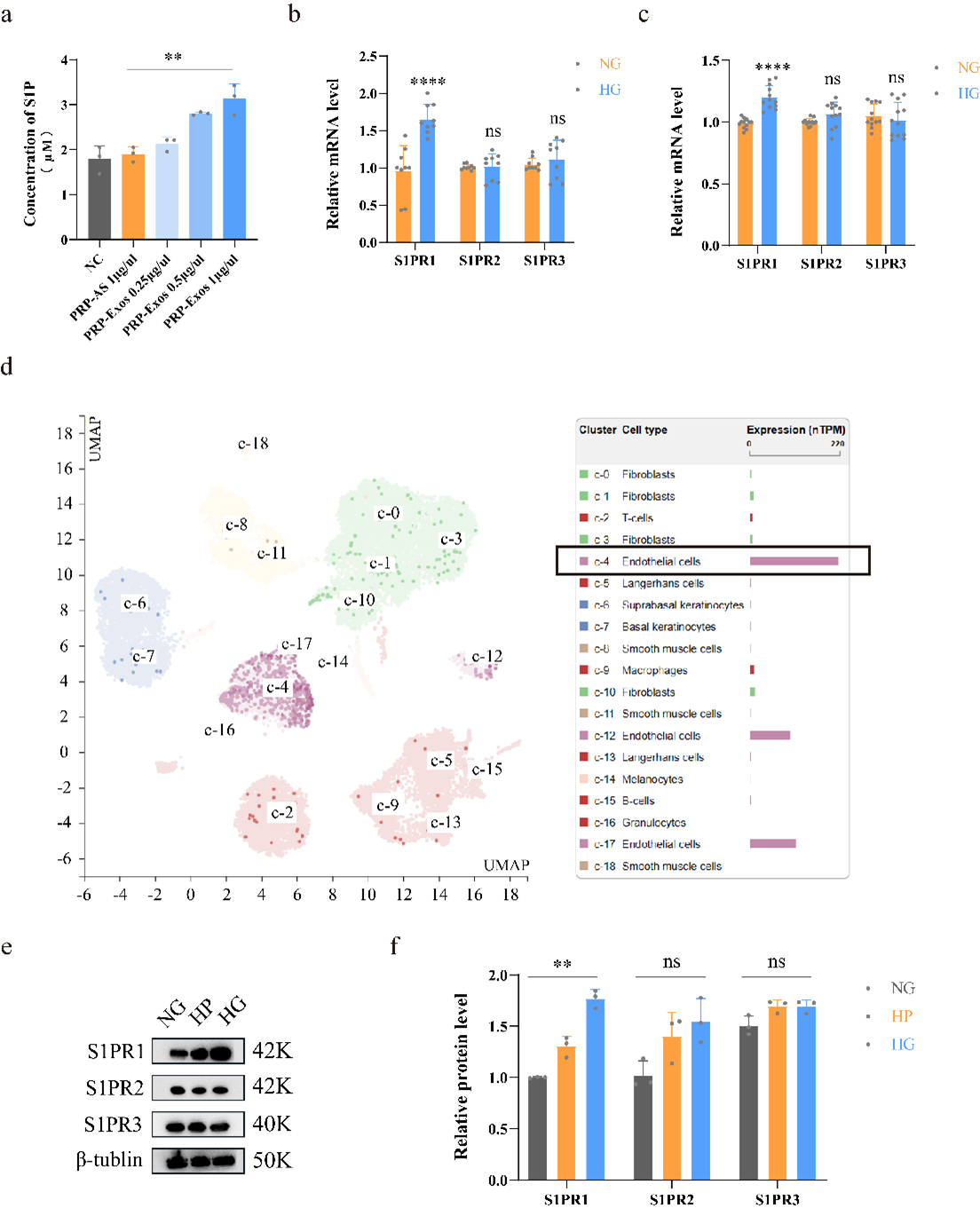 图3.(a)通过ELISA实验,检测不同浓度PRP-Exos、PRP-AS以及NC中的S1P含量。(b)RT-qPCR量化分析糖尿病与非糖尿病患者皮肤组织中的S1PR1-3的差异表达。(c)RT-qPCR量化分析糖尿病与非糖尿病小鼠皮肤组织中的S1PR1-3的差异表达。(d)生物信息学分析网站Human Protein Atlas中的数据表明,在正常人体皮肤中,S1PR1高富集于内皮细胞中。(e-f)通过蛋白免疫印迹法检测NG、HP与HG中S1PR1-3的表达情况。****P < 0.0001, ***P < 0.001, **P < 0.01,ns表示没有显著性差异。
图3.(a)通过ELISA实验,检测不同浓度PRP-Exos、PRP-AS以及NC中的S1P含量。(b)RT-qPCR量化分析糖尿病与非糖尿病患者皮肤组织中的S1PR1-3的差异表达。(c)RT-qPCR量化分析糖尿病与非糖尿病小鼠皮肤组织中的S1PR1-3的差异表达。(d)生物信息学分析网站Human Protein Atlas中的数据表明,在正常人体皮肤中,S1PR1高富集于内皮细胞中。(e-f)通过蛋白免疫印迹法检测NG、HP与HG中S1PR1-3的表达情况。****P < 0.0001, ***P < 0.001, **P < 0.01,ns表示没有显著性差异。
因此,通过构建shS1PR1的HUVECs细胞株,作者开展了更为深入的研究。Western blotting的结果证实,PRP-Exos可显著上调磷酸化AKT、促血管因子VEGF-A以及组织测序结果筛选出来的纤维连接蛋白-1(fibronectin 1, FN1)的表达量(图4)。但是,当PRP-Exos干预shS1PR1的HUVECs时,前者对磷酸化AKT、VEGF-A和FN1的显著上调效果大打折扣。随后的shS1PR1腺病毒干预糖尿病小鼠创面闭合的研究中同样证实,当S1PR1的表达量受到抑制时,糖尿病小鼠的创面闭合率显著降低。并且,当PRP-Exos传递S1P信号无法被S1PR1成功接收时,其促创面闭合效果也受到明显阻滞。因此,在高糖环境下,PRP-Exos来源的S1P依赖于结合S1PR1,从而发挥显著地促血管新生与促创面修复效应。
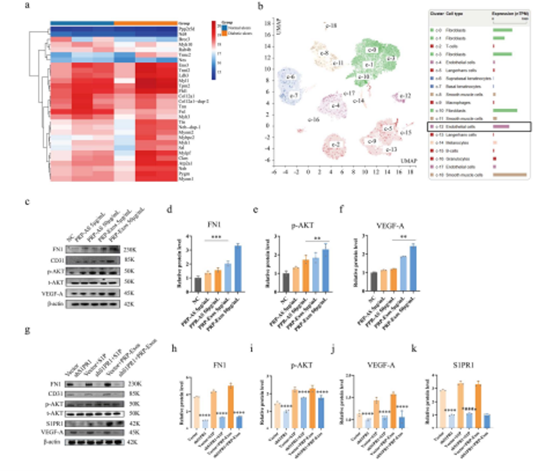 图4.(a)组织蛋白测序结果,FN1在糖尿病患者皮肤中显著下调。(b)生物信息学分析网站Human Protein Altals的数据表明,在正常人皮肤中,FN1在内皮细胞存在高表达。(c-f)在不同干预后,FN1,p-AKT,VEGF-A的表达量被蛋白免疫印迹法检测并量化分析。(g-k)在不同干预后,FN1、p-AKT、VEGF-A和S1PR1的表达量被蛋白免疫印迹法检测并量化分析。****P < 0.0001, ***P < 0.001, **P < 0.01。
图4.(a)组织蛋白测序结果,FN1在糖尿病患者皮肤中显著下调。(b)生物信息学分析网站Human Protein Altals的数据表明,在正常人皮肤中,FN1在内皮细胞存在高表达。(c-f)在不同干预后,FN1,p-AKT,VEGF-A的表达量被蛋白免疫印迹法检测并量化分析。(g-k)在不同干预后,FN1、p-AKT、VEGF-A和S1PR1的表达量被蛋白免疫印迹法检测并量化分析。****P < 0.0001, ***P < 0.001, **P < 0.01。
随后,作者通过使用AKT磷酸化抑制剂LY294002和AKT磷酸化激活剂SC79证实,在高糖环境下,PRP-Exos可通过结合S1PR1传递S1P信号,从而激活磷酸化AKT通路,促进下游FN1和VEGF-A的表达(图5)。在后续研究中,作者使用了靶向结合FN1的siRNA,实现对FN1表达的抑制。当FN1表达量受到抑制时,HUVECs合成与分泌VEGF-A的含量也呈明显下降的趋势。该研究证实,FN1不仅可以作为细胞外基质的主要成分发挥营养支持作用,同样可以作为调控蛋白参与到VEGF-A的调节中。
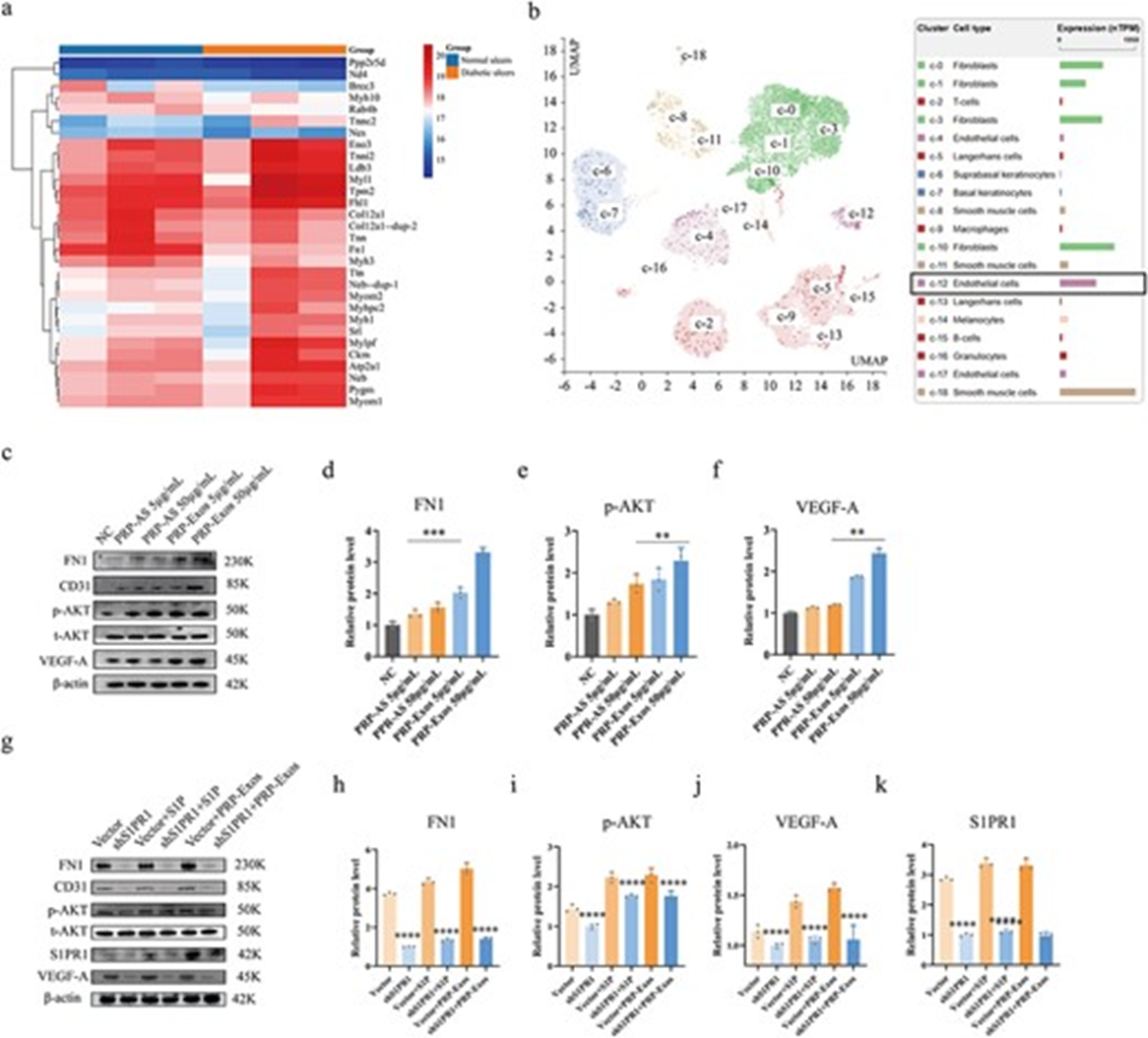 图5.(a-h)在不同处理后,FN1、p-AKT、VEGF-A的表达量被蛋白免疫印迹法检测并量化分析。(i-l)细胞免疫荧光实验用于检测不同处理后FN1的免疫荧光强度情况。***p < 0.001, **P < 0.01, *P < 0.05。
图5.(a-h)在不同处理后,FN1、p-AKT、VEGF-A的表达量被蛋白免疫印迹法检测并量化分析。(i-l)细胞免疫荧光实验用于检测不同处理后FN1的免疫荧光强度情况。***p < 0.001, **P < 0.01, *P < 0.05。
该研究初步探索了PRP-Exos来源的S1P在糖尿病创面修复中的作用和潜在分子机制。揭示了高糖环境下,PRP-Exos来源的S1P可通过S1PR1/AKT/FN1通路促进糖尿病创面修复。这项研究结果,可为未来临床开展PRP-Exos治疗DFUs提供理论依据,具有重要的转化作用。
参考文献:
Sphingosine-1-phosphate derived from PRP-Exos promotes angiogenesis in diabetic wound healing via the S1PR1/AKT/FN1 signalling pathway. Burns Trauma. 2023;11:tkad003.
外泌体资讯网 Burns & Trauma | 重庆大学附属中心医院邓武权: 血小板外泌体源性磷酸鞘氨醇-1促进糖尿病创面修复的机制研究





