不到50%的主动脉瓣钙化患者伴有动脉粥样硬化,这意味着发病机制不同。尽管循环细胞外囊泡 (EV) 是心血管疾病的生物标志物,组织包埋的EV与早期矿化有关,但它们的货物、功能和对疾病的贡献仍然未知。近日,来自哈佛医学院的Elena Aikawa研究组在Circulation杂志上发表文章,首次报道了针对人类颈动脉斑块和钙化主动脉瓣的比较蛋白质组学研究,确定了动脉粥样硬化与主动脉瓣狭窄的独特驱动因素,并表明EVs与晚期心血管钙化有关。
心血管钙化与心肌梗死、中风和心力衰竭的发生率相关,并可通过其预测发病率和死亡率。尽管动脉和心脏瓣膜的病理性矿化有许多共同的危险因素,但只有25%至50%的患者患有心血管钙化。瓣膜钙化也会导致血管钙化,这意味着不同的疾病驱动因素。组织病理学研究将这两种情况描述为大致可比,并且对这种明显悖论的后续研究很少。尽管组织学相似,但他汀类药物等药物疗法成功地减轻了动脉粥样硬化患者的炎症并降低了胆固醇,但未能改善主动脉瓣狭窄的预后,从而使患者得不到有效的治疗。起促钙化作用的细胞外囊泡 (EV) 提供了一种可能的解释;它们是心血管矿化的重要驱动因素和组成部分。EV是所有人类细胞类型分泌的小型膜结合结构,遍布身体的组织和体液。它们含有主动选择的生物活性物质(脂质、蛋白质、和非编码microRNA),并介导细胞间通讯。冠状动脉疾病患者的循环EV水平升高,并与心血管死亡、血运重建和主要不良心血管事件发生的较高风险相关。引起了人们对循环中EV货物作为心血管疾病生物标志物的关注,但捕获在心血管组织内的EV仍未得到充分研究。
在体外,病变血管和瓣膜中发现的细胞类型的EV直接驱动钙化。培养的巨噬细胞释放具有高聚集潜力的EV,使羟基磷灰石成核,并且在钙化条件下来自血管平滑肌细胞 (SMC) 的EV负载有促矿化膜联蛋白、磷脂酰丝氨酸和降低水平的钙化抑制剂。这些EV作为矿物质的位点。成核并调节早期斑块微钙化的形成。最近的工作已将EV定位于人类动脉粥样硬化斑块和慢性肾病患者的钙化血管中;然而,尽管组织捕获的EV可能介导斑块内的细胞间信号传导,但之前尚未对其进行表征。与从生物流体中直接分离EV不同,为下游应用提取足够纯度、质量和数量的组织EV面临着巨大的挑战。 因此,组织EV含量很少被研究,并且仅在更容易破坏的大脑或肿瘤样本中进行研究。因此,组织EV是对假定疾病机制和治疗靶点的生物学见解的丰富的、未开发的来源。
该研究解决了围绕人类动脉粥样硬化动脉和狭窄主动脉瓣钙化差异发病机制的持续不确定性。由于与血管和瓣膜疾病有关的细胞类型的病理性EV分泌,作者假设组织包埋的囊泡货物有助于心血管钙化的共享和组织特异性调节。利用整体蛋白质组学,检查了人类颈动脉斑块和钙化主动脉瓣内疾病的3个不同阶段,确定了动脉粥样硬化与主动脉瓣狭窄的独特驱动因素,以及两种组织疾病进展中与EV相关的途径。在蛋白质组学的指导下,开发了一种EV分离方法,该方法使用酶消化、顺序离心、超速离心和密度梯度分离来从纤维钙化人体组织中富集EV。最后,我们通过应用蛋白质组学、小RNA测序、多组学整合、多维网络分析和系统方法来研究正常和患病的心血管组织囊泡组,以从组织EV货物中获得生物学见解。在此过程中,评估了EV作为血管和瓣膜钙化独特发病机制的调节剂。
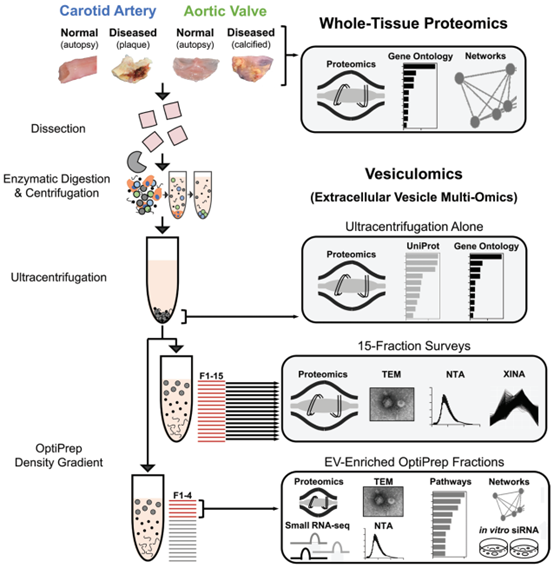
实验概述:心血管组织包埋的细胞外囊泡的分离和分析
方法:对人颈动脉内膜切除标本 (n=16) 和狭窄主动脉瓣 (n=18) 进行疾病阶段特异性蛋白质组学分析。通过酶消化、(超)离心和密度梯度离心方法进行EV分离,通过蛋白质组学、CD63-免疫金电子显微镜和纳米颗粒跟踪分析验证。囊泡组学,包括囊泡蛋白质组学和小RNA测序,是在组织EV上进行的。TargetScan识别出microRNA目标。通路网络分析优先基因,以在原代人颈动脉平滑肌细胞和主动脉瓣间质细胞中进行验证。
结果:疾病进展导致颈动脉斑块和钙化主动脉瓣蛋白质组(2318 个蛋白质)显著趋同(P<0.0001)。 每个组织还保留了差异富集蛋白质的独特子集(斑块中381个;瓣膜中226个;q<0.05)。两种组织中受疾病调节的蛋白质中的囊泡gene ontology术语增加了2.9倍(P<0.0001)。 蛋白质组学在组织消化物中鉴定出了22 个EV 标记。动脉和瓣膜EV中的蛋白质和microRNA靶标网络因疾病进展而改变,揭示了细胞内信号传导和细胞周期调节的共同参与。囊泡组学鉴定了仅在动脉或瓣膜EV中因疾病而差异富集的773种蛋白质和80种microRNA(q<0.05);多组学整合发现组织特异性EV货物分别与颈动脉和主动脉瓣中的前钙化Notch和Wnt信号相关。 敲低人颈动脉平滑肌细胞中的组织特异性EV货物 FGFR2、PPP2CA和ADAM17以及人主动脉瓣膜间质细胞中的WNT5A、APP和APC可显著调节钙化。
该研究描绘了一种囊泡组学策略,用于分离、纯化和研究纤维钙化组织中捕获的EV中的蛋白质和RNA货物。通过网络方法整合囊泡蛋白质组学和转录组学揭示了组织EV在调节心血管疾病中的新作用。
参考文献:
Blaser MC, Buffolo F, Halu A, Turner ME, Schlotter F, Higashi H, Pantano L, Clift CL, Saddic LA, Atkins SK, Rogers MA, Pham T, Vromman A, Shvartz E, Sukhova GK, Monticone S, Camussi G, Robson SC, Body SC, Muehlschlegel JD, Singh SA, Aikawa M, Aikawa E. Multiomics of Tissue Extracellular Vesicles Identifies Unique Modulators of Atherosclerosis and Calcific Aortic Valve Stenosis. Circulation. 2023 Jul 10. doi: 10.1161/CIRCULATIONAHA.122.063402. PMID: 37427430.





