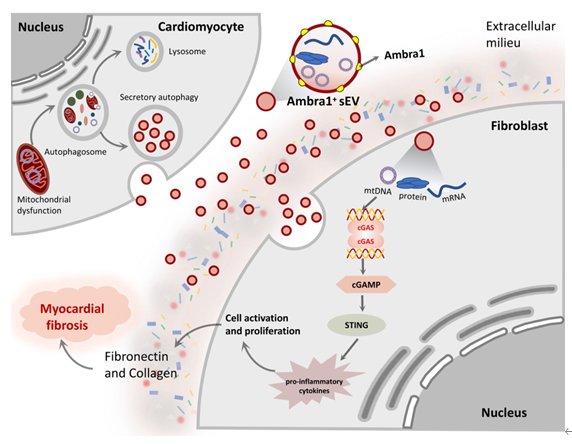
心肌纤维化是心肌缺血/再灌注(MI/R)损伤后引发心源性猝死的重要原因。MI/R损伤可导致心肌细胞损伤甚至死亡,而成纤维细胞却出现激活、增殖并导致纤维化和心脏重构,导致这一矛盾现象的细胞间通讯机制仍不清楚。因此,阐明MI/R损伤后心肌纤维化过程中,成纤维细胞和心肌细胞之间的细胞间通讯机制具有重要意义。小细胞外囊泡(small extracellular vesicles, sEVs)在细胞间通讯中起重要作用,通过将蛋白质、脂质和核酸等细胞成分从供体细胞运输到受体细胞,参与广泛的病理生理过程。基于上述生物学功能,sEVs在心血管疾病的临床诊断和治疗中的作用日益受到关注。但是,sEVs是否以及如何介导MI/R后心肌细胞和成纤维细胞间的通讯尚属未知。近日,空军军医大学基础医学院生理学与病理生理学系马恒教授团队于Science Bulletin上发表了题为“Intercellular mitochondrial component transfer triggers ischemic cardiac fibrosis”的研究论文(2023, 24;S2095-9273(23)00479-6)。
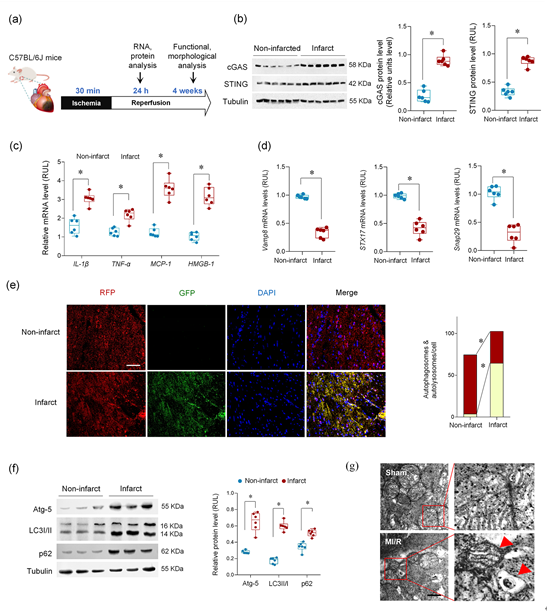
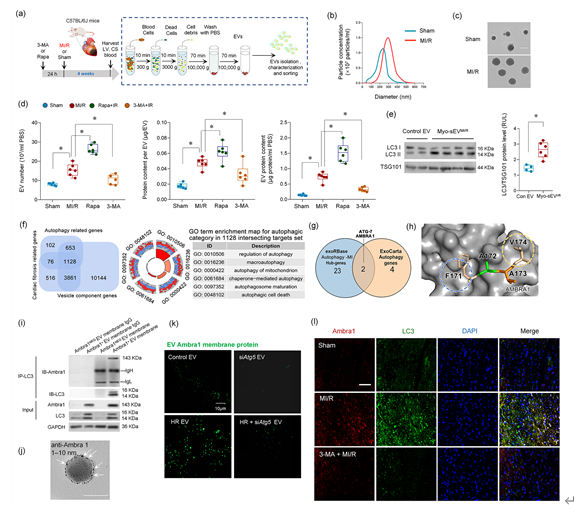
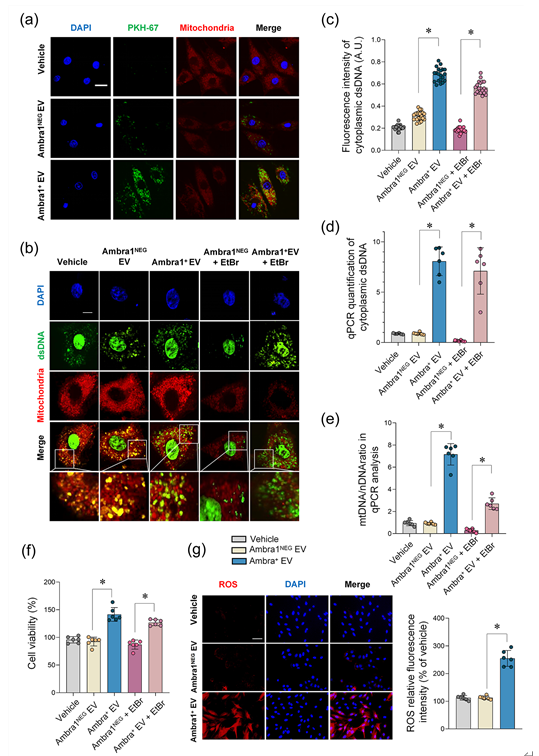
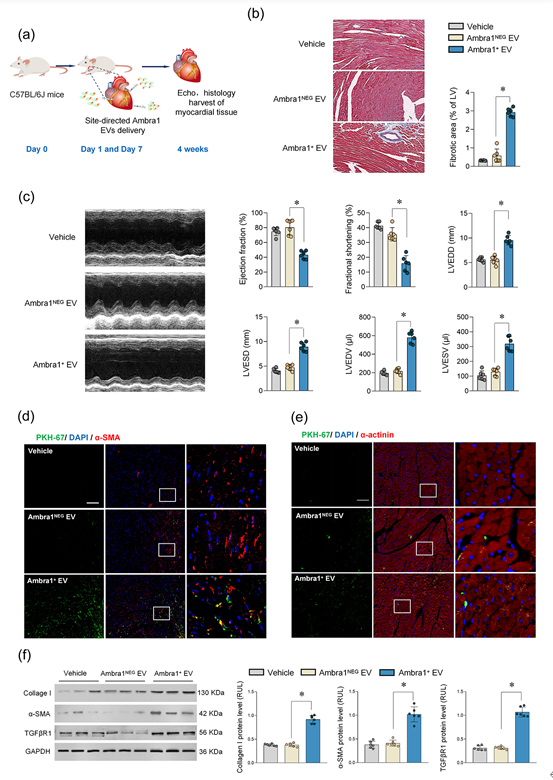
该文通过在体MI/R模型和细胞学实验发现,MI/R损伤情况下存在一种心肌细胞来源的sEV(Myo-sEVI/R),其内容物富含线粒体成分。Myo-sEVI/R被成纤维细胞摄取并触发其增殖活化,最终导致纤维化。在这项研究中,通过生物信息学筛选和实验验证,新发现Ambra1是Myo-sEVI/R中的关键组分和潜在标志物。并且证实,Ambra1定位于Myo-sEVI/R表面;Ambra1+-Myo-sEVs的释放是由MI/R损伤后心肌细胞的分泌型自噬所驱动,而不是经典的降解型自噬。在缺血和缺血周边区域,Ambra1+-Myo-sEVs被成纤维细胞内吞导致跨细胞线粒体成分传递;线粒体DNA(mtDNA)激活cGAS-STING通路,促进成纤维细胞的活化和增殖。此外,该研究的数据显示,心脏特异性的下调Ambra1可抑制Ambra1+-Myo-sEVs的释放和成纤维细胞摄取,有效抑制缺血后心肌纤维化。首先,研究者检测了MI/R后心肌纤维化的程度和分子特征,发现MI/R可导致梗死区发生病理性纤维化、cGAS-STING通路激活和自噬体降解障碍。值得注意的是,实验结果发现在未降解的自噬小体中富含线粒体成分。进而,从左心室血中纯化并分离出心肌sEVs(Myo-sEVs),同时使用纳米颗粒跟踪分析(NTA)和电镜来评估Myo-sEVs的大小分布和形态(图2)。结果表明,与Myo-sEVsSham相比,Myo-sEVsI/R尺寸更大、数量更多且蛋白含量更高。进一步通过实验发现,Myo-sEVsI/R的形成和释放受到自噬功能状态驱动;缺血再灌注损伤的心肌细胞以分泌型自噬的方式形成Myo-sEVsI/R。通过生物信息学分析发现与细胞自噬密切相关的功能分子Ambra1是Myo-sEVsI/R的重要分子标志;Ambra1与LC3紧密结合并定位于Myo-sEVsI/R膜表面。在证明了Ambra1+-Myo-sEVsI/R起源于心肌后,研究者进一步发现成纤维细胞能够优先摄取Ambra1+-Myo-sEVsI/R;其所内含的心肌来源mtDNA被成纤维细胞内化,激活成纤维细胞cGAS-STING通路,促进成纤维细胞的病理性增殖。进一步通过gain-and-loss实验在细胞和在体动物水平证实 Ambra1+-Myo-sEVsI/R可被成纤维细胞摄取,激活cGAS-STING 通路,导致心肌纤维化和心脏功能受损;心肌特异性敲低Ambra1可降低Myo-sEVsI/R的分泌,一定程度抑制成纤维细胞cGAS-STING的激活以及炎症因子的表达,减轻MI/R导致的心肌纤维化程度。综上所述,这项研究表明心肌来源的细胞外囊泡是MI/R后的一种新的细胞间通讯介质。该研究创新性地证实了MI/R损伤的心肌细胞可通过分泌型自噬的方式将受损的线粒体成分外排,并被成纤维细胞摄取,实现跨细胞的线粒体成分传递;阐明了Ambra1可能是分泌性自噬相关的Myo-sEVI/R的新型标志分子,并具有重要的生物活性;靶向Ambra1+-Myo-sEVs可能是缓解MI/R损伤引发纤维化和心脏重构的新策略,该研究为缺血后心脏重塑提供了新的治疗靶点。Intercellular mitochondrial component transfer triggers ischemic cardiac fibrosis. Sci Bull(Beijing). Available online 24 July 2023. doi.org/10.1016/j.scib.2023.07.030.外泌体资讯网 Science Bulletin | 空军军医大学马恒教授团队:跨细胞线粒体成分传递触发缺血后心肌纤维化的新机制