细胞外囊泡(EVs)作为一种重要的细胞间通讯方式在细胞间信号传递和物质递送等方面发挥着重要作用。来源自供体细胞的EVs可以通过各种内吞途径内化进入受体细胞并对其生理活动进行相应调节,所以定量分析受体细胞对EVs的摄取对于深入探究囊泡-细胞间的相互作用具有重要意义。然而目前缺乏对细胞摄取的EV进行准确定量的分析手段。现有的EV定量方法包括直接对囊泡颗粒数(NanoFCM、NTA、DLS等)或对其主要生物组分(蛋白质、核酸、脂质等)的定量策略,然而这些方法只能用于纯化的EVs定量而不能用于细胞摄取EVs的定量研究。而荧光探针标记等策略只能对细胞摄取的EV进行成像和半定量分析,准确性有限。
近日,国家蛋白质科学中心(北京)研究团队发展了一种基于镧系金属离子的sEVs(30-150 nm的细胞外囊泡)特异性标记和绝对定量方法。研究工作以“Absolute Quantification of Dynamic Cellular Uptake of Small Extracellular Vesicles via Lanthanide Element Labeling and ICP-MS”为题发表在Anal Chem 上(doi:10.1021/acs.analchem.3c01421)。
该方法利用镧系金属铕离子(Eu3+)与sEV膜表面磷酸根之间的特异性相互作用来实现对sEVs的标记。进而通过联合使用NanoFCM和ICP-MS分别对铕标记后的sEVs的囊泡颗粒数和铕含量进行检测分析,得到了Eu-sEVs中的铕含量相对于囊泡颗粒数的标准曲线。最终利用金属铕在ICP-MS中的高灵敏响应和在细胞中极低的背景干扰来实现对细胞摄取sEVs的绝对定量。
利用该技术,研究者开展了不同孵育时间和温度条件下,受体细胞对Eu-sEVs摄取的定量分析。发现HeLa细胞以一种时间依赖和温度依赖的方式摄取sEVs,并且这种摄取是一种主动的、耗能的过程而不是被动的膜融合过程。最后,通过使用已知途径的化学内吞抑制剂处理受体细胞后与Eu-sEVs共孵育,发现HeLa细胞摄取sEVs的主要途径是巨胞饮内吞途径而不是网格蛋白依赖的内吞途径。由于此标记方法具有ppb级别的灵敏度以及较好的生物相容性和标记稳定性,有希望能够成为EVs在细胞间通讯和药物递送等方面研究的有力工具。
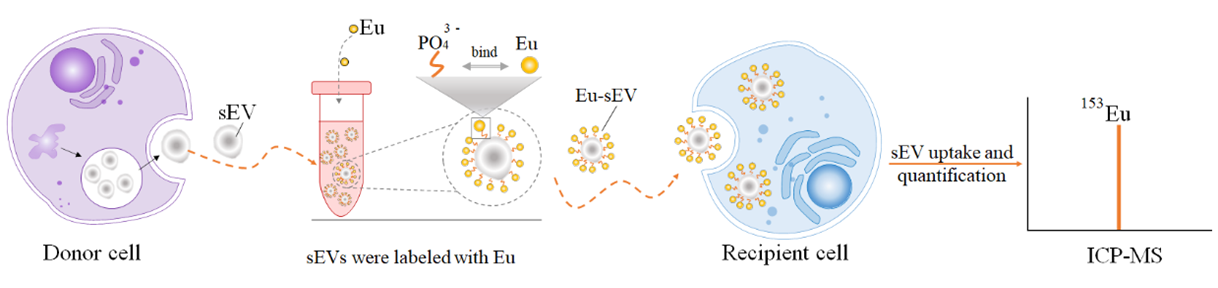
一种基于镧系金属离子的sEVs特异性标记和绝对定量方法
参考文献:
Absolute Quantification of Dynamic Cellular Uptake of Small Extracellular Vesicles via Lanthanide Element Labeling and ICP-MS. Anal Chem, 2023 Aug 1.doi: 10.1021/acs.analchem.3c01421.
外泌体资讯网 Anal Chem|国家蛋白质科学中心(北京)研究团队:镧系元素标记和ICP-MS对细胞动态摄取细胞外囊泡的绝对定量





