许多原核生物和真核生物细胞分泌有脂质双层结构的囊泡。这些细胞外囊泡(EV)现在被认为是细胞间通讯的重要介质,参与生理和病理过程,包括免疫反应和肿瘤进展。
EV的分类基于其大小和生物发生。通过质膜外向释放的母细胞产生的EV,直径在50nm到1μm以上之间,被称为微囊泡或外泌体。其他一些称为外泌体,具有内体起源,并通过多囊体与质膜融合的胞吐方式释放。外泌体是直径小于150nm的小囊泡,富含内体来源的成分。
EVs的组成取决于它们的细胞起源,分泌它们的细胞的生理状态以及它们的生物发生机制。EVs包含可溶性细胞质蛋白、核酸、脂质以及许多跨膜蛋白。其中,三个四跨膜蛋白家族成员CD9、CD63和CD81是广泛使用的EV亚群标记,并用作免疫分离EV的靶标。
四跨膜蛋白是一类蛋白质超家族,其特征是具有四个跨膜区域和两个胞外区域中最大的一个的特定折叠。所有细胞类型和组织都表达不同的四跨膜蛋白组合,其中一些主要存在于质膜上,例如CD9,或相反地存在于细胞内,例如CD63,后者富集在晚期内体和溶酶体相关的细胞器中。四跨膜蛋白已涉及广泛的细胞功能,并且它们在小鼠或人类中的缺陷有时会产生显著的影响。在分子水平上,四跨膜蛋白调节其直接分子伴侣的转运、膜分区和功能。例如,小鼠和人类中CD81缺陷导致由于CD19表达减少而导致的体液反应受损,CD19是关键的B细胞共刺激分子。CD63 KO小鼠由于pmel转运和加工的改变而具有受损的色素沉着能力,pmel是参与黑色素生成的分子,以及肾功能异常,包括多尿并伴有尿渗透压下降以及有机阳离子转运体OCT2的错位。重要的是,CD9和CD81是密切相关的四跨膜蛋白,共享45%的同源性,并在细胞融合过程中发挥类似的作用。它们都在精子-卵子融合中发挥关键作用,但对HIV诱导的合胞体形成以及巨噬细胞和肌肉细胞融合产生负面调节作用。CD9和CD81都直接与两个相关的Ig结构域蛋白CD9P-1/EWI-F(由PTGFRN基因编码)和EWI-2(由IGSF8基因编码)结合,并且这些蛋白质也调节了几个融合过程。
CD9、CD81和CD63在EV生物发生和功能中的作用尚不清楚。有人认为tetraspanins可能在EV定位和摄取中发挥作用,或者作为exosomes的分选机制。最近的一项研究发现,CD9和CD63在EV内容传递过程中没有发挥作用的证据。为了验证第二个假设,该研究通过质谱分析了MCF7细胞分泌的EV的蛋白质组成,这些细胞缺乏或不缺乏用于EV表征的主要tetraspanins,即CD9、CD81和CD63。
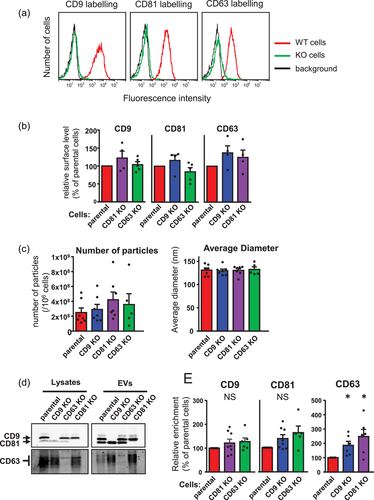
缺乏CD9、CD81或CD63的MCF7细胞及其释放的EV的特征
该报道研究了CD9、CD81和CD63在MCF7乳腺癌细胞系中的作用。在MCF7乳腺癌细胞系中,CD63主要位于细胞内,而CD9和CD81则强烈共定位于质膜,尽管在不同的位置具有不同的比例,这可能解释了EVs中CD81的富集。然而,这些tetraspanins的缺失对EV蛋白质组成的影响很小,如通过定量质谱分析。此外,还分析了同时敲除CD9和CD81的效应,因为这两个tetraspanins在几个细胞过程中发挥类似的作用,并直接与两个Ig域蛋白CD9P-1/EWI-F/PTGFRN和EWI-2/IGSF8结合。这些是双重、缺陷细胞EVs中唯一显著减少的蛋白质。在EWI-2的情况下,这主要是由于细胞表达水平降低。总之,本研究表明,在MCF7细胞释放的EVs中,通常用作EV蛋白标记物的CD9、CD81和CD63在确定EV蛋白质组成方面的作用较小,并强调了CD9和CD81对CD9P-1和EWI-2的表达水平和/或转运的调节。
参考文献:
Fan Y, Pionneau C, Cocozza F, Boëlle PY, Chardonnet S, Charrin S, Théry C, Zimmermann P, Rubinstein E. Differential proteomics argues against a general role for CD9, CD81 or CD63 in the sorting of proteins into extracellular vesicles. J Extracell Vesicles. 2023 Aug;12(8):e12352. doi: 10.1002/jev2.12352. PMID: 37525398; PMCID: PMC10390663.