细胞外囊泡(EV)是一种纳米级别的细胞间信使,具有作为生物药物递送载体的巨大应用潜力。通过使用基因工程的供体细胞装载或装饰蛋白质、肽或RNA已经取得了很大进展,但在EV分离后进行药物的装载和使用来自自然来源的EV仍然具有挑战性。特别是,仍然缺乏定量和明确的数据,评估小分子与EV相对于样品中其他组分的关联方式。诺华生物医学研究所的研究人员在Journal of Controlled Release杂志上发表文章,报道了被动装载疏水或胆固醇标记的小分子后,细胞囊泡(EV)的定量和功能表征。
细胞外囊泡(EV)是生理学上的纳米信使,它们在细胞、组织和生物体之间交换分子信息。它们可以穿过生物屏障,并使用与高度传染性病毒相似的途径被其接收细胞高效地摄取。此外,它们具有生物相容性并易于组合工程。因此,EV具有解决制药药物传递瓶颈的巨大潜力。将这种新的药物传递技术转化为现实需要强大而有效的方法来将EV与药理活性载荷一起装载,同时保留囊泡的物理化学和功能特性。这提出了一个内在的概念性挑战,因为特别是那些不可生物利用且因此需要传递载体才能到达其靶组织的药物通常显示出较差的膜渗透性;不易穿过细胞屏障的物质本质上也不容易穿过EV的双脂质膜。低渗透性和生物利用度实际上是许多现代药物的主要限制因素,这些药物越来越基于复杂的大分子结构,例如短寡核苷酸、mRNA、肽支架、异双功能配体(“分子胶”、PROTAC)或其他超越Lipinski五法则的复杂分子。如果能够解决它们的传递挑战,这些新型模式无疑将开辟全新的可药用空间。
根据最新的研究,目前最先进的应用是在生产细胞内在EV的生物合成过程中将生物药物纳入其中。该领域的努力在于确定和表征细胞蛋白质、氨基酸和RNA基序的效率,以作为EV分选域的功能,为如何将外源RNA或蛋白质引入EV提供了不断增长的知识库。直接融合以及与Tetraspanins或RNA结合蛋白等可逆相互作用已成功应用于EV的装载和细胞因子诱饵受体、可溶性蛋白或小RNA的功能传递。然而,这些策略仅限于使用生物合成兼容的货物和EV来源,其中父母细胞易于进行基因操作。因此,对于合成小分子、非天然肽或化学修饰RNA以及来自天然来源(包括食品、牛奶和其他生物流体或原代人类细胞)的EV,需要后隔离装载策略。目前的文献包括许多例子,描述了通过机械操作(如电穿孔、超声波、挤压和重复冷冻/解冻循环)或使用生化添加剂(如皂苷或温和的清洁剂)进行EV装载。一个有吸引力的概念是将货物从脂质体或脂质纳米粒子转移至EV中进行融合,从而产生嵌合“混合”小泡。这种策略具有很大的潜力,因为它已经被证明在实践中是可行的,并且很可能具有可扩展性;主要未解决的问题是这些嵌合物制剂是否将证明是两者的最佳组合,即LNP和EV,或者是否可能将LNPs的缺点(如耐受性和生物利用度有限)与EVs的制造和成本挑战相结合。然而,许多研究追求的最简单的策略是利用疏水相互作用将化合物被动吸附到EVs上。这些可以是与化合物本身结合,例如Curcumin、Doxorubicin、Paclitaxel或Resveratrol,也可以通过添加亲脂性标记(尤其是胆固醇)来将RNA或其他亲水性配体锚定到EV膜上。尽管其中一些“配方”已在体内使用甚至接近临床试验,但仍有许多未解决的问题。特别是,仍然缺乏明确的数据来回答以下问题:(1)这些化合物是否以及如何选择性地与EVs(更具体地说,是外泌体)结合而不是样品中的其他组分;(2)相互作用模式和装载计量比是什么;(3)这些如何调节小泡的物理化学特性和功能活性;(4)这些配方在生物液体中有多稳定。这些问题对于被动装载EVs的未来临床转化以及从各种来源开发新的和改进后分离方法来说都至关重要。
该研究使用定量单小泡成像、分析FPLC-SEC(快速蛋白液相色谱-分子排斥色谱)、定量冷冻TEM(透射电子显微镜)和LC-HRMS(液相色谱-高分辨质谱)来定量、定性和功能性地表征EVs与合成货物的装载,这是被广泛使用的两种被动装载EVs策略之一:与高logP化合物的疏水相互作用,以及通过胆固醇标记将亲水性配体锚定到膜中。
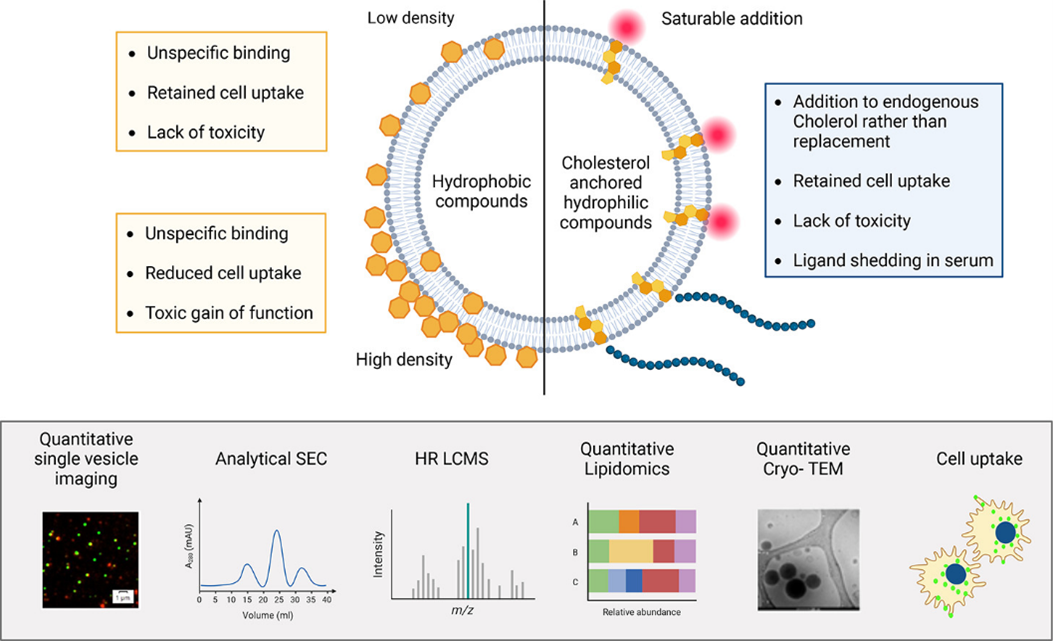
该研究描述了基于疏水相互作用的小分子被动EV装载的系统性和定量表征,这种相互作用可以通过疏水化合物的直接吸附或通过胆固醇标签通过膜锚定亲水配体来实现。单个囊泡成像显示,两种配体类型都与CD63阳性EV(外泌体)结合,但也非特异性地结合到其他囊泡、颗粒和血清蛋白上。Curcumin和Terbinafine等疏水化合物在EV上聚集,每个囊泡上的分子数量高达106-107,由液相色谱-高分辨质谱(LC-HRMS)定量。对于这两种化合物,高密度EV装载导致大量电子密度囊泡的形成,这些囊泡可通过定量冷冻透射电镜(TEM)检测到,Curcumin-EVs具有细胞毒性增益和减少的EV细胞摄取。相比之下,胆固醇标记的亲水mdm2靶向环肽在每个囊泡中饱和密度约为104-105分子,脂质组学显示添加而不是替换内源性胆固醇。胆固醇锚定配体不会改变EV的大小或形态,并且这样的EV保留了其细胞摄取活性而不引起细胞毒性。然而,在血清存在下,胆固醇锚定配体会迅速从囊泡中脱落。
根据这些数据,研究人员得出结论:(1)两种方法都允许将小分子装载到EV中,但如果样品中存在,则容易发生非特异性化合物结合或重新分配到其他组分中;(2)胆固醇锚定需要大量优化配方稳定性,以适用于体内应用;(3)在依赖EV与疏水化合物的疏水相互作用时,需要仔细调节装载密度,以减轻物理化学性质的变化、EV功能的丧失和潜在的细胞毒性。
参考文献:
Tréton G, Sayer C, Schürz M, Jaritsch M, Müller A, Matea CT, Stanojlovic V, Melo-Benirschke H, Be C, Krembel C, Rodde S, Haffke M, Hintermann S, Marzinzik A, Ripoche S, Blöchl C, Hollerweger J, Auer D, Cabrele C, Huber CG, Hintersteiner M, Wagner T, Lingel A, Meisner-Kober N. (2023) Quantitative and functional characterisation of extracellular vesicles after passive loading with hydrophobic or cholesterol-tagged small molecules. J Control Release 361:694-716.





