Cell Death & Differentiation |天津市人民医院高明教授团队:M2巨噬细胞来源的外泌体诱导的肿瘤细胞m6A甲基化异常是影响甲状腺癌免疫治疗耐药的关键机制
甲状腺癌是内分泌系统最常见的恶性肿瘤,近三十年来全球范围内的甲状腺癌发病率持续迅速增长。虽然大部分甲状腺癌患者可以通过手术切除和放射治疗被成功治疗,但其中一部分会发展为难治性疾病,而这部分患者缺乏有效的治疗手段。随着免疫治疗在其他实体瘤中取得成功,人们开始探索甲状腺癌患者免疫治疗的可行性。然而免疫治疗在甲状腺癌中的初步结果令人失望,临床反应率仅不到10%,因此亟需找到甲状腺癌中诱导免疫治疗抵抗的关键,从而探索靶向治疗联合免疫治疗的新策略。
近日,天津市人民医院高明教授团队于Cell Death & Differentiation发表题为“METTL3 inhibition induced by M2 macrophage-derived extracellular vesicles drives anti-PD-1 therapy resistance via m6A-CD70-mediated immune suppression in thyroid cancer“的研究论文 (doi: 10.1038/s41418-023-01217-x)。该研究发现在甲状腺癌中,M2型巨噬细胞来源的外泌体通过改变肿瘤细胞中的m6A甲基化水平诱导了免疫治疗耐药。利用体内外实验证实,激活METTL3及靶向下游关键分子可以有效逆转M2型巨噬细胞诱导的免疫治疗抵抗,为晚期甲状腺癌提供了一种新的治疗策略。天津市人民医院甲状腺乳腺外科高明教授与天津医科大学附属肿瘤医院甲状腺颈部肿瘤科郑向前教授和阮先辉博士为文章的共同通讯作者,天津市人民医院博士后宁俊雅,甲状腺乳腺外科郝洁博士及天津医科大学附属肿瘤医院甲状腺颈部肿瘤科候秀坤博士为文章的并列第一作者。
研究团队首先通过对甲状腺癌组织的批量RNA测序及单细胞测序数据分析发现,METTL3低表达与免疫治疗抵抗有关,并且METTL3低表达的肿瘤细胞与T细胞和调节性T细胞的相互作用显著增强。接着研究团队利用重建人免疫系统的NCG小鼠模型证实了在甲状腺癌中激活METTL3可以减少肿瘤组织中免疫抑制性的调节性T细胞和终末耗竭性T细胞的比例,进而改善免疫抑制微环境,并有效提高免疫治疗的敏感性。经过对机制的深入研究,发现M2型巨噬细胞通过分泌外泌体激活甲状腺癌细胞中的miR-21-5p/METTL3/CD70轴,一方面上调调节性T细胞及终末耗竭性T细胞的比例,另一方面进一步促进M2抵抗。
此外,研究团队证实利用靶向CD70的单克隆抗体cusatuzumab可以逆转M2型巨噬细胞来源的外泌体导致的免疫治疗抵抗,为靶向治疗和免疫治疗的联合治疗在临床甲状腺癌中的应用提供了理论依据。
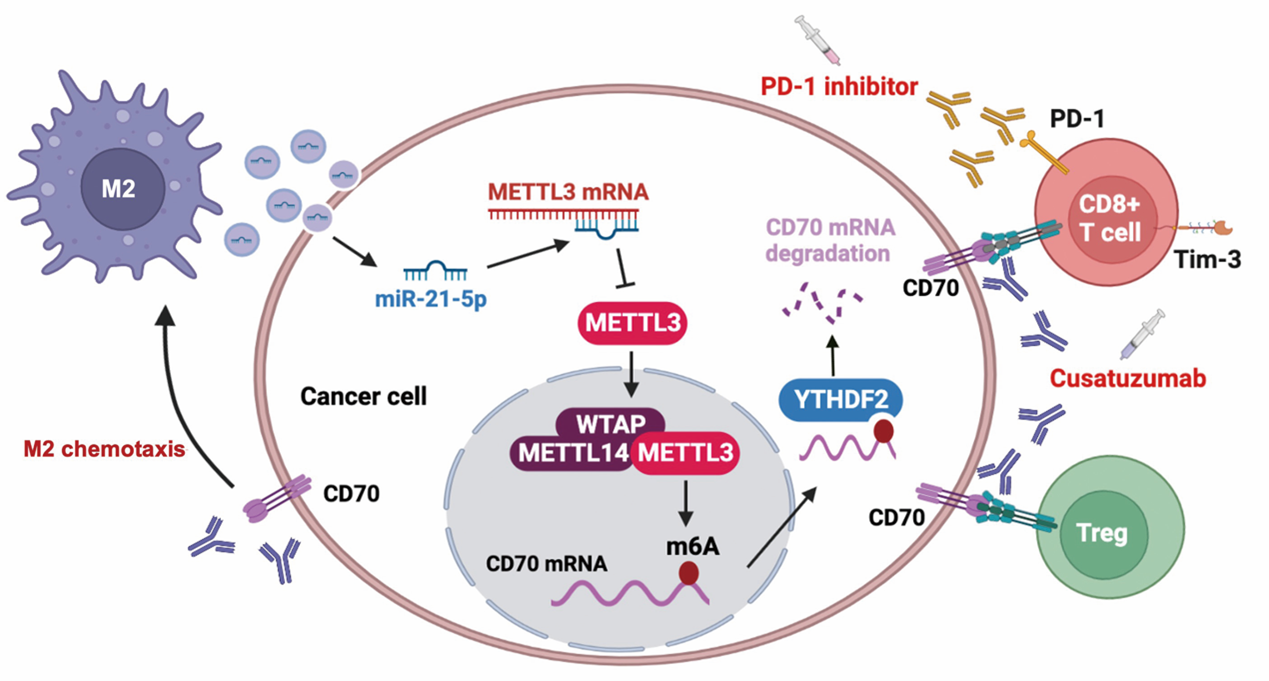
示意图:M2型巨噬细胞的趋化,形成正反馈环路,从而诱导免疫抑制微环境,导致免疫治疗抵抗
参考文献:
METTL3 inhibition induced by M2 macrophage-derived extracellular vesicles drives anti-PD-1 therapy resistance via M6A-CD70-mediated immune suppression in thyroid cancer, Cell Death Differ. 2023 Aug 30. doi: 10.1038/s41418-023-01217-x.
外泌体资讯网 Cell Death Differ|天津市人民医院高明:M2型巨噬细胞来源外泌体通过改变肿瘤细胞m6A甲基化水平诱导免疫治疗耐药





