免疫调节在心脏稳态和心肌梗死(MI)修复中起着重要作用。其中,心脏常驻巨噬细胞(cardiac resident macrophages, cMacs)因其血管生成、炎症调节和 改善电耦合等功能而备受关注。然而,由于低存活率和免疫排斥反应,移植 cMacs用于心血管疾病治疗仍存在一定争议。相反,利用在受体细胞中能够激发类似反应的细胞外囊泡进行治疗可能是一种可行和安全的心脏再生替代方案。
近日,南方医科大学区彩文团队 在Acta Biomaterialia杂志上发表了题为“Targeted heart repair by Tβ4-loaded cardiac-resident macrophage-derived extracellular vesicles modified with monocyte membranes”研究文章(2023 Aug 18;S1742-7061(23)00484-1),作者们构建了一种用于靶向心脏修复的膜修饰载药纳米颗粒(Tβ4-MmEVs)用于心肌梗死后的心脏修复。
组织常驻巨噬细胞作为先天免疫系统中的组成部分广泛分布于众多组织中,它们起源于胚胎期组织并在组织中持续存在,其在组织发育、自我更新、维持生理稳态、组织修复和重塑以及免疫反应中发挥着重要作用。最近的研究表明,心脏巨噬细胞(cMacs)在心脏发育、冠状动脉成熟和心脏稳态调节过程中发挥着重要的生理功能。研究人员根据C-C趋化因子受体的存在与否将cMacs分为不同的亚群,并观察到不同时期小鼠中cMacs的组成和比例存在着差异,同时这些不同的巨噬细胞亚群在心脏损伤后的重塑过程中表现出不同的生物功能。值得一提的是,心肌梗死后,心肌组织中CCR2+巨噬细胞群通过募集循环中的单核细胞和单核细胞衍生的巨噬细胞而得到补充,而CCR2 -巨噬细胞群的数量则骤降。补充心脏常驻CCR2 -巨噬细胞群可能是治疗心肌梗死的潜在策略。CCR2-巨噬细胞群在心肌梗死后的心肌修复上发挥着至关重要的作用,而其来源的细胞外囊泡在心肌修复上的作用尚未被研究。
细胞外囊泡(extracellular vesicles, EVs)作为细胞间的通讯载体,可以将分子从一种细胞类型传递到另一种细胞类型,并调节受体细胞的生物学功能。细胞外囊泡治疗替代细胞移植疗法,可以成为促进组织再生的重要策略之一。然而,由于需要与体液中的内源性细胞外囊泡竞争、单核吞噬细胞系统(MPS)的高吞噬作用,治疗性细胞外囊泡在疾病中的应用受到了一定限制。膜修饰的细胞外囊泡可以高度改善治疗性细胞外囊泡在生物内的分布,规避细胞外囊泡在靶器官中快速清除,从而达到治疗目的。此外,细胞外囊泡已经成为携带药物到受损细胞的潜在治疗载体。然而,它们的药物输送效率尚未达到预期,尤其是对于亲水性药物。与传统的被动装药相比,chen等人介绍的一种“超声和挤压辅助主动装载”(SEAL)的方法能够有效地提高药物的封装效率。在这项研究中,作者提取了乳鼠的心脏常驻巨噬细胞(cMacs),分离常驻巨噬细胞衍生的细胞外囊泡(mEVs),通过 SEAL 方法主动加载亲水性小分子活性蛋白Tβ4,并用单核细胞的细胞膜(M)进行修饰以模仿心肌梗死后循环中单核细胞的动员并靶向受损心脏的病理生理过程,构建了一种能够靶向心脏的载药膜修饰纳米颗粒(Tβ4-MmEVs)(如图 1 所示)。
 图1:Tβ4-MmEVs的构建示意图。(A)心脏常驻巨噬细胞的亚群及其心脏保护作用。(B)Tβ4-MmEVs的制备过程图解。(C) Tβ4-MmEVs的心脏保护作用的潜在机制
图1:Tβ4-MmEVs的构建示意图。(A)心脏常驻巨噬细胞的亚群及其心脏保护作用。(B)Tβ4-MmEVs的制备过程图解。(C) Tβ4-MmEVs的心脏保护作用的潜在机制
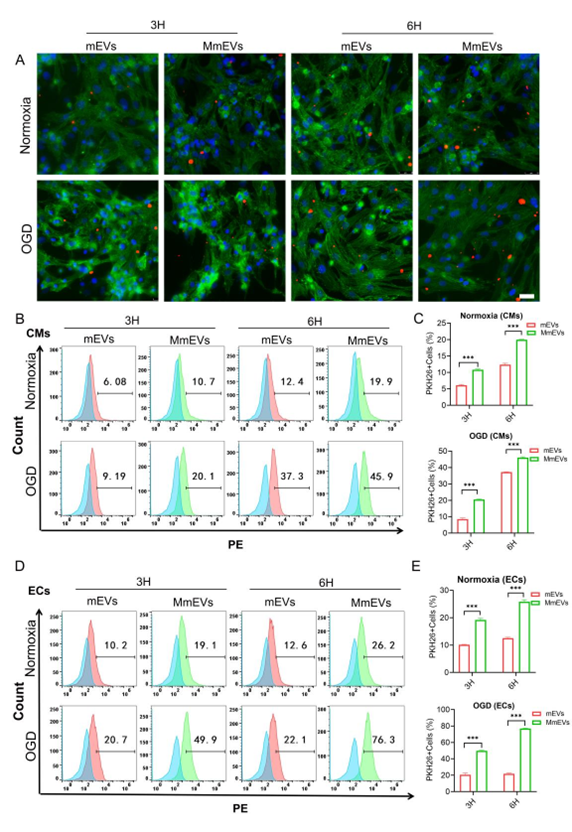
该研究通过体外免疫荧光和流式细胞术实验验证了膜修饰能够促进损伤的心肌细胞和内皮细胞对细胞外囊泡的摄取。另外,流式细胞学结果表明,mEVs 表现出区别于其他治疗性细胞外囊泡的优越的免疫逃避功能,其中的机制可能是mEVs 衍生于低表达 MHCII 蛋白的 cMacs 亚群,有效地规避了免疫系统的吞噬。此外,该研究利用体内IVIS系统追踪了MmEVs和mEVs的体内分布,结果表明,Tβ4-MmEVs一方面能够靶向缺损的心脏组织,另一方面能够逃避免疫系统的快速清除,在靶器官心脏中形成有效聚集。结果证明了 MmEVs 的体内靶向能力和免疫规避功能,与体外实验结果保持一致。
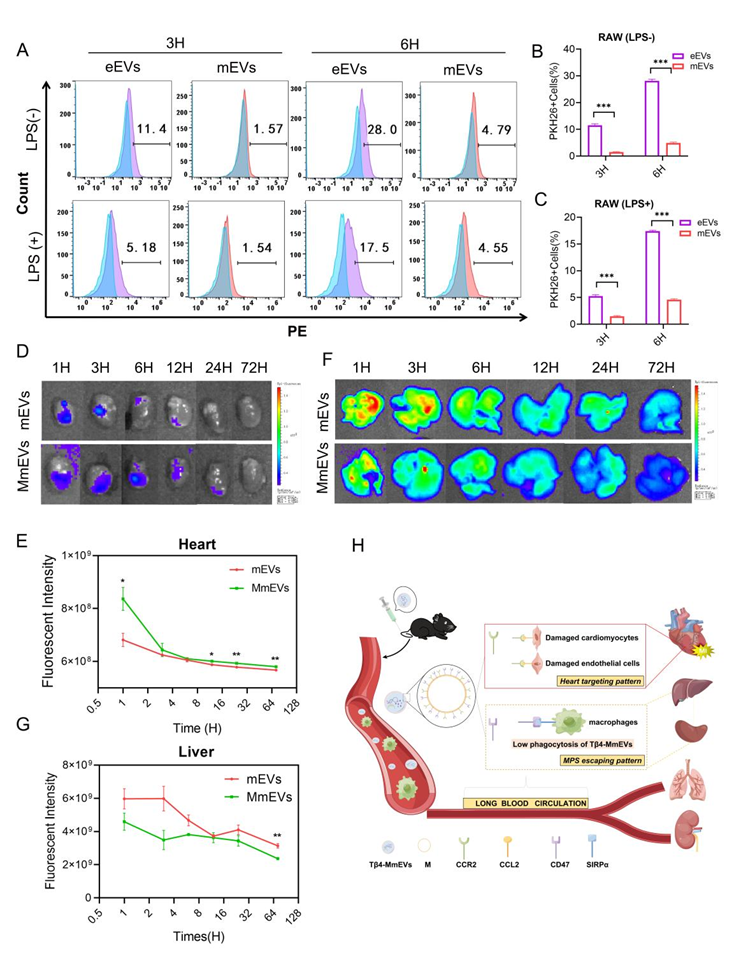 图3:Tβ4-MmEVs的免疫逃避和心脏靶向功能。
图3:Tβ4-MmEVs的免疫逃避和心脏靶向功能。
心脏常驻巨噬细胞高表达蛋白CD47,与先天免疫细胞上的受体SIRP相互作用后激活“不要吃我”信号,导致单核吞噬细胞系统(MPS)对mEVs的吞噬减少。由于心脏常驻巨噬细胞来源的细胞外囊泡(mEVs)表面携带了CD47分子以及单核细胞膜蛋白与CCL2分子之间的强亲和力,Tβ4-MmEVs表现出非凡的免疫逃避能力和对心脏受损区域的靶向定位能力。该研究还通过体内外实验分别验证了Tβ4-MmEVs能够促进心肌细胞和内皮细胞的增殖以及促进心肌梗死后的心脏修复。因此,同源性的高活性的膜修饰纳米颗粒的有效开发和实施将对临床心肌梗死的辅助治疗提供一定的参考价值。
参考文献:
Targeted heart repair by Tβ4-loaded cardiac-resident macrophage-derived extracellular vesicles modified with monocyte membranes, Acta Biomaterialia, 2023 Aug 17;S1742-7061(23)00484-1. doi: 10.1016/j.actbio.2023.08.022.PMID: 37597679
外泌体资讯网 Acta Biomaterialia丨南方医科大学区彩文 :单核细胞膜修饰的负载Tβ4的心脏巨噬细胞来源的细胞外囊泡靶向心脏修复