前列腺癌(PCa)是西方男性泌尿生殖系统发病率最高的肿瘤,也是导致男性死亡的第二大癌症。随着城市化发展程度和生活水平的提高,近年我国PCa的发病率和死亡率也不断增加。早期PCa呈雄激素依赖性,称为雄激素敏感或雄激素依赖性前列腺癌(ADPC),其经雄激素去势治疗、手术或放射疗法后,多数患者早期都有较好的疗效,但治疗2~3年后约10%的患者发展为极度恶性的雄激素非依赖性PCa(AIPC),亦称为去势抵抗性前列腺癌(CRPC),易发生骨转移,预后不良,已成为危害男性健康的重大疾病之一,发病机制尚不完全清楚。
近日,浙大二院临床检验中心陶志华/刘伟伟团队发表题为“Exosomal miR-222-3p contributes to castration-resistant prostate cancer by activating mTOR signaling”的研究论文 (doi: 10.1111/cas.15948)。该研究团队揭示CRPC转化新机制“AIPC-Exos旁分泌调控”(示意图如下),AIPC细胞来源的外泌体可携带miR-222-3p 转运至ADPC细胞,进而驯化ADPC细胞向AIPC细胞转化。体内外实验进一步证实,Exos-miR-222-3p可靶向MIDN激活mTOR信号轴介导CRPC转化,为CRPC的诊治提供新的研究思路和策略。浙大二院临床检验中心陶志华教授和刘伟伟特聘研究员为共同通讯作者,浙大二院临床检验中心硕士研究生王未希和孔飘萍(导师为刘伟伟特聘研究员)为文章的并列第一作者。
研究团队首先通过miRNA高通量测序对LNCaP、LNCaP-AI和PC3的miRNA表达谱进行分析,发现miRNA-222-3p在AIPC细胞株中异常高表达,而且miRNA-222-3p过表达可促进PCa细胞增殖和迁移侵袭能力。进一步研究发现LNCaP-AI细胞的外泌体可促进LNCaP细胞增殖活性及迁移侵袭能力,并且可增强LNCaP细胞对去雄激素培养的耐受性。利用免疫荧光和细胞共培养技术,团队证实AIPC细胞来源的外泌体可携带miR-222-3p 转运到 ADPC 细胞,进而促进 ADPC 细胞向AIPC细胞转化;通过miRNA靶基因生物信息预测,并利用荧光素酶报告基因检测、qPCR进一步发现和证实MIDN是miRNA-222-3p的一个靶mRNA。此外,研究团队在细胞和动物水平发现Exos-miR-222-3p可靶向MIDN激活mTOR信号通路介导AIPC转化。利用临床标本,研究团队发现CRPC病人外周血Exos-miR-222-3p的表达显著高于ADPC病人,而且CRPC病人外周血来源的外泌体可显著增强LNCaP细胞的生长活性。这些结果表明Exos-miR-222-3p有望作为CRPC的潜在诊断标志物和治疗靶点。
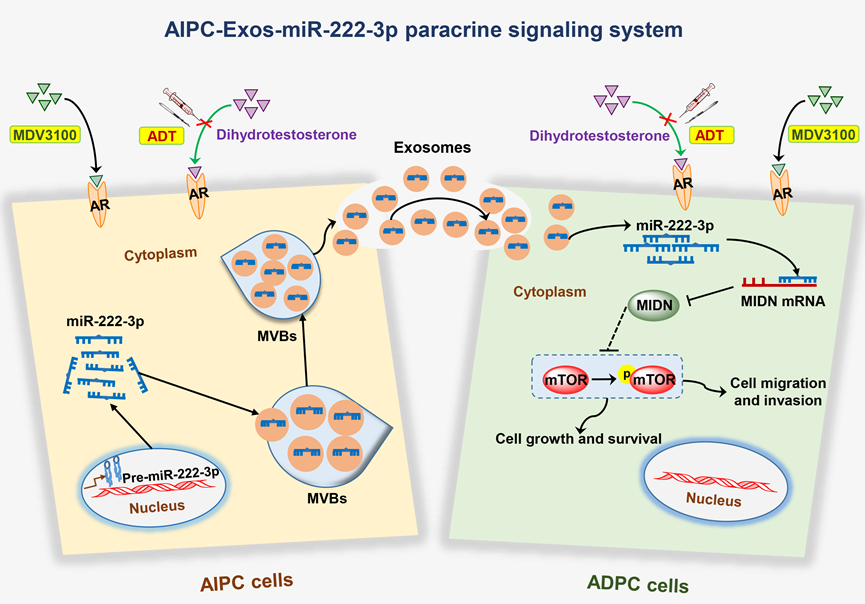
示意图:AIPC-Exos旁分泌调控诱导CRPC转化参考文献:Exosomal miR-222-3p contributes to castration-resistant prostate cancer by activating mTOR signaling, Cancer Sci,2023;10.1111/cas.15948.撰稿:刘伟伟 特聘研究员 审阅:陶志华 教授
外泌体资讯网 Cancer Science|浙大二院临床检验中心陶志华/刘伟伟:外泌体通过激活mTOR信号通路促进去势抵抗性前列腺癌进展





