Coya Therapeutics, Inc.(“Coya”或“公司”)是一家临床阶段的生物技术公司,开发多种治疗平台,旨在增强Treg功能,包括生物制品和细胞疗法。该公司宣布,卡内基·梅隆大学(CMU)生物医学工程教授Phil Campbell博士于2023年9月7日上午在波士顿举行的第五届基于外泌体的治疗开发峰会上发表了题为“快速功能化Treg外泌体用于靶向免疫治疗”的演讲。Coya和CMU在2022年签署了一份研究合作协议和选择协议,旨在开发一种独特的专利技术,以推进外泌体在治疗未满足需求的疾病方面的潜在应用。在这项研究中,通过使用一种专有的胆固醇DNA系带技术,演示了Treg外泌体膜可以被工程化地控制性地固定CTLA-4,一种膜表面活性蛋白质,到Treg外泌体表面,从而形成稳定的CTLA-4-Treg外泌体。还演示了CTLA-4-Treg外泌体在代表性免疫细胞中(J7774小鼠细胞系和人类Jurket细胞系的巨噬细胞和T细胞)比未经修饰的Treg EVs表现出更好的细胞摄取。此前,卡内基梅隆大学使用相同的技术,通过工程化基质细胞来源的外泌体,将免疫调节性凋亡诱导蛋白Fas配体(FAS-L)引入外泌体中。结果表明,针对性地传递FASL-外泌体显著增强了其治疗效果,增强了小鼠肿瘤细胞的凋亡和抑制了异基因T细胞,同时最小化了潜在的非靶向效应。Tregs是重要的免疫调节细胞,具有控制炎症、促进自身耐受性和促进再生过程的关键作用。Treg衍生的外泌体与母细胞具有许多相似的特性,使它们能够调节生理和病理过程。 专有技术生成外泌体聚合物杂交体(EPH),这种技术使用寡核苷酸连接器对Treg衍生的外泌体进行有效和多功能的工程和定制。将EPH传递到引起特定疾病的炎症部位或表位,同时传递定制的载荷,可以实现下一代选择性靶向和强效的Treg衍生外泌体。工程外泌体可能具有多种优势,包括低免疫原性、改善稳定性、系统性输送后增加血浆保留时间和局部输送后增加驻留时间、增强生物分布、改善细胞结合和摄取以及增强靶向治疗反应。
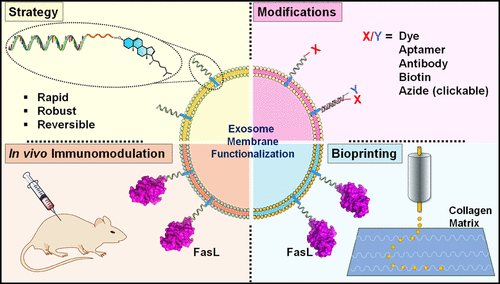
外泌体因其在细胞之间转移生物载荷的自然作用,显示出作为药物递送理想载体的潜力。然而,目前的方法在不对其功能产生负面影响的情况下工程化外泌体仍然具有挑战性。操纵分泌外泌体的细胞复杂且耗时,而直接功能化外泌体表面蛋白则具有低特异性和低效率。该研究近期发表于ACS Nano杂志,该研究展示了一种快速、多功能和可扩展的方法,使用寡核苷酸连接物在人类和小鼠外泌体上实现了多样化的表面功能化。这些外泌体表面修饰物从反应性功能基团和小分子到寡核苷酸和大蛋白等范围广泛,可以方便高效地增强天然外泌体的性能。该研究展示了通过连接的AS1411寡核苷酸可以特异性改变细胞对外泌体的摄取,并且通过连接的蛋白可以改变靶向特异性。该研究使用免疫调节蛋白FasL对外泌体进行功能化,并在体外和体内证明了它们的生物活性。当在胶原基质上生物打印FasL功能化的外泌体时,可以在肿瘤细胞中诱导凋亡;当注射到小鼠中时,可以抑制异基因T细胞的增殖。这种寡核苷酸连接策略独立于外泌体来源,并进一步避免了对分泌外泌体的细胞进行基因修饰。参考文献:Yerneni SS, Lathwal S, Shrestha P, Shirwan H, Matyjaszewski K, Weiss L, Yolcu ES, Campbell PG, Das SR. Rapid On-Demand Extracellular Vesicle Augmentation with Versatile Oligonucleotide Tethers. ACS Nano. 2019 Sep 24;13(9):10555-10565. doi: 10.1021/acsnano.9b04651. Epub 2019 Aug 27. PMID: 31436946; PMCID: PMC6800810.