抑郁障碍(Major depressive disorder,MDD)是最常见的重性精神疾病,其病因不清、病机不明,至今仍缺乏用于临床实践的诊断生物标志物。脑组织神经细胞释放的携带致病性蛋白分子的细胞外囊泡(Extracellular vesicles,EVs)可穿过血脑屏障(Blood brain barrier,BBB)进入血液。随着外周血不同亚型脑细胞来源细胞外囊泡(Brain cell-derived extracellular vesicles,BCDEVs)富集方法的建立,采用外周血不同亚型BCDEVs筛选可做为中枢神经系统疾病生物标记物的候选分子已在多种神经退行性疾病中显现出其诊断和鉴别诊断优势。围绕抑郁障碍,近期发表的四篇论著对比分析了MDD患者及其正常对照组外周血神经元标记EVs胰岛素受体底物-1、线粒体蛋白、EVs的大小及其miRNA水平以及星形胶质细胞标记EVs中炎症分子的差异,为筛选MDD脑源性诊断生物标记物提出了新思路新方法。
张志珺教授(东南大学/深圳理工大学)、孔岩副教授(东南大学)和孟志强高级工程师(中科院深圳先进技术研究院)团队在Genes & Diseases(IF=7.243,Q1)上在线发表了题为“Vitamin D-binding protein in plasma microglia-derived extracellular vesicles as a potential biomarker for major depressive disorder”的论著 (2023 Apr 10;11(2):1009-1021),第一次跨物种证实了血浆小胶质细胞来源细胞外囊泡(Microglia-derived extracellular vesicles,MDEVs)中维生素D结合蛋白(Vitamin D-binding protein,VDBP)具备MDD诊断生物标志物潜能。该论著第一作者为张高嘉博士生(MD),并一作者为李玲博士生(PhD)。
在过去的半个多世纪,国内外研究者致力于从多维度多层面寻找MDD客观诊断标志。但因为MDD患者在体脑组织活检难以落实,尸检脑组织研究极少且干扰因素诸多,加之发现的多通路差异表达分子难以重复,而基于外周血、唾液、尿液和粪便等筛选的候选分子不能直接反映中枢。另外,由于抑郁症病因不清病机不明,使得靶向关键分子的正电子发射型计算机断层显像(Positron Emission Computed Tomography,PET)对抑郁症的早期诊断仍处于科研起步阶段。
张志珺教授队基于蛋白组学结合生物信息学和机器学习分析并经多重验证,前期研究发现了MDD患者血浆和尸检脑组织-背外侧前额叶皮层(dorsolateral prefrontal cortex,DLPFC)中VDBP水平选择性显著升高。因此,这项研究旨在通过测定外周血中神经细胞标记外泌体中VDBP,进一步筛选可以代表中枢的外周血MDD诊断生物标记物。为了实现这一目标,研究者首先对MDD和健康对照(Healthy control,HC)受试者血浆中三种BCDEVs内VDBP水平进行定量分析,寻找存在差异性表达BCDEVs亚型,然后分别在抑郁样行为的小鼠和恒河猴中验证这种差异性表达的中枢及外周一致性或相关性。
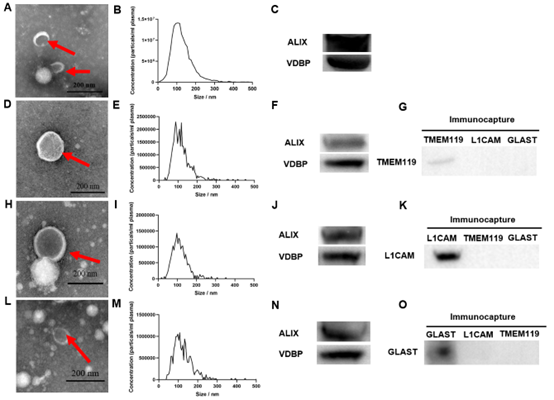
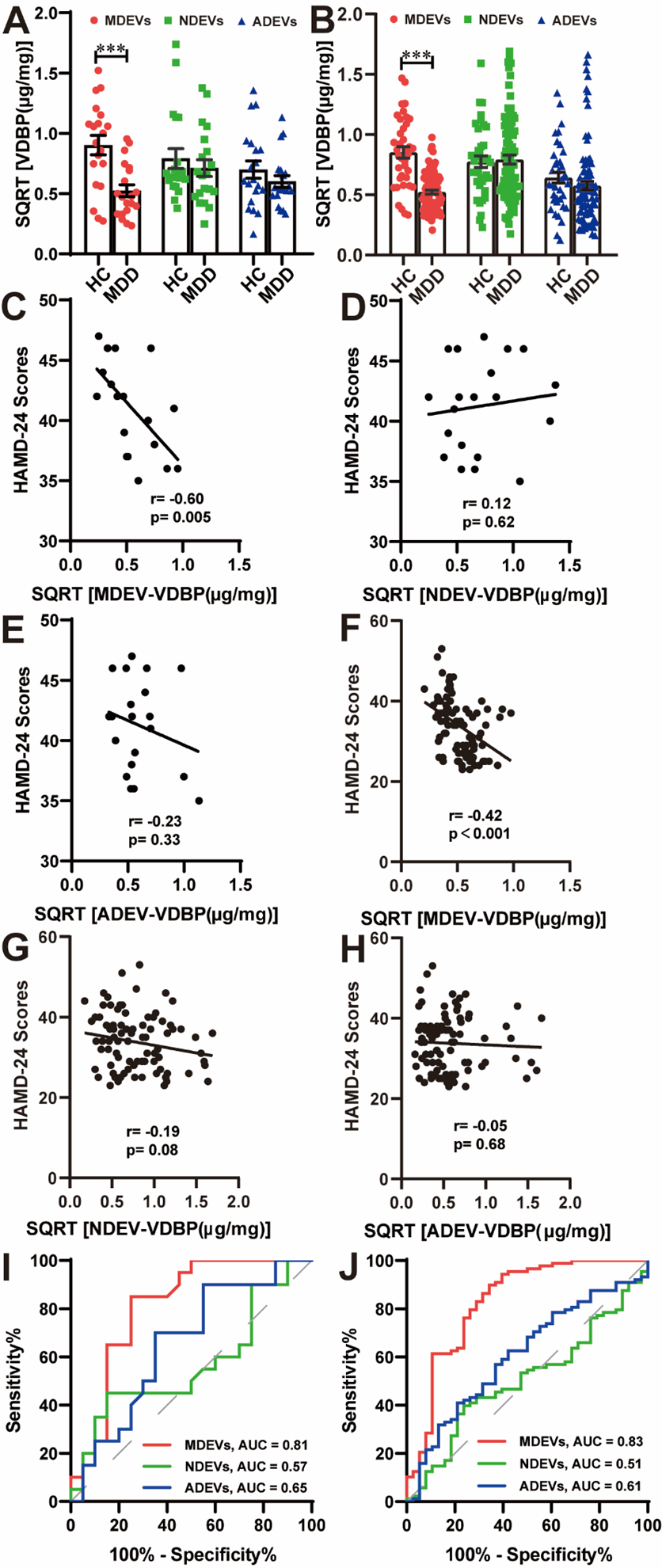
通过从人类受试者血浆(所有受试者的外周血样均是禁食过夜后的上午8:00~9:00之间采集,EDTA抗凝,立即低温离心分离血浆,-80℃保存)中分别富集了三种主要BCDEVs,包括神经元来源细胞外囊泡(Neuron-derived extracellular vesicles,NDEVs)、星形胶质细胞来源细胞外囊泡(Astrocytes-derived extracellular vesicles,ADEVs)和小胶质细胞来源细胞外囊泡(microglia-derived extracellular vesicles,MDEVs)(首先通过ExoQuick沉淀法富集总EVs,然后用锚定细胞类型特异性表面蛋白抗体的磁珠分离相应细胞类型来源的外泌体囊泡),随后,采用透射电子显微镜(Transmission Electron Microscope,TEM)、纳米颗粒示踪分析(Nanoparticle Tracking Analysis,NTA)和蛋白质免疫印迹(Western blotting,WB)完成三种不同BCDEVs表征鉴定(图1)。定量分析MDD患者组和HC组的“发现队列”(20例MDD患者 vs. 匹配的20例健康对照)和“验证队列”(88例MDD患者 vs. 38例健康对照)受试者血浆三种不同BCDEVs中VDBP水平,其中MDD患者均为首发未使用抗抑郁药物或停用抗抑郁药物至少2周以上者,结果发现MDD患者血浆三种BCDEVs中,仅MDEVs中VDBP水平显著低于HC组,差异有显著性(发现队列t=4.014,p<0.001;验证对列t=8.017,p<0.001); MDD患者组血浆MDEVs中VDBP水平与汉密尔顿抑郁量表24项(Hamilton Depression Rating Scale-24 item,HAMD-24)总评分呈显著负相关(发现队列r=-0.60,p=0.005;验证对列r=-0.42,p<0.001);“发现队列”和“验证队列”受试者工作特征曲线(Receiver operating characteristic curve,ROC)分析曲线下面积(Area under curve,AUC)分别为0.81(敏感性=85.00%,特异性=75.00%)和0.83(敏感性=89.80%,特异性=65.80%)(图2)。
图1 人血浆TEVs和三种BCDEVs表征分析
图2 “发现队列”和“验证队列”血浆BCDEVs中VDBP水平及其与HAMD-24评分的相关性和诊断效能
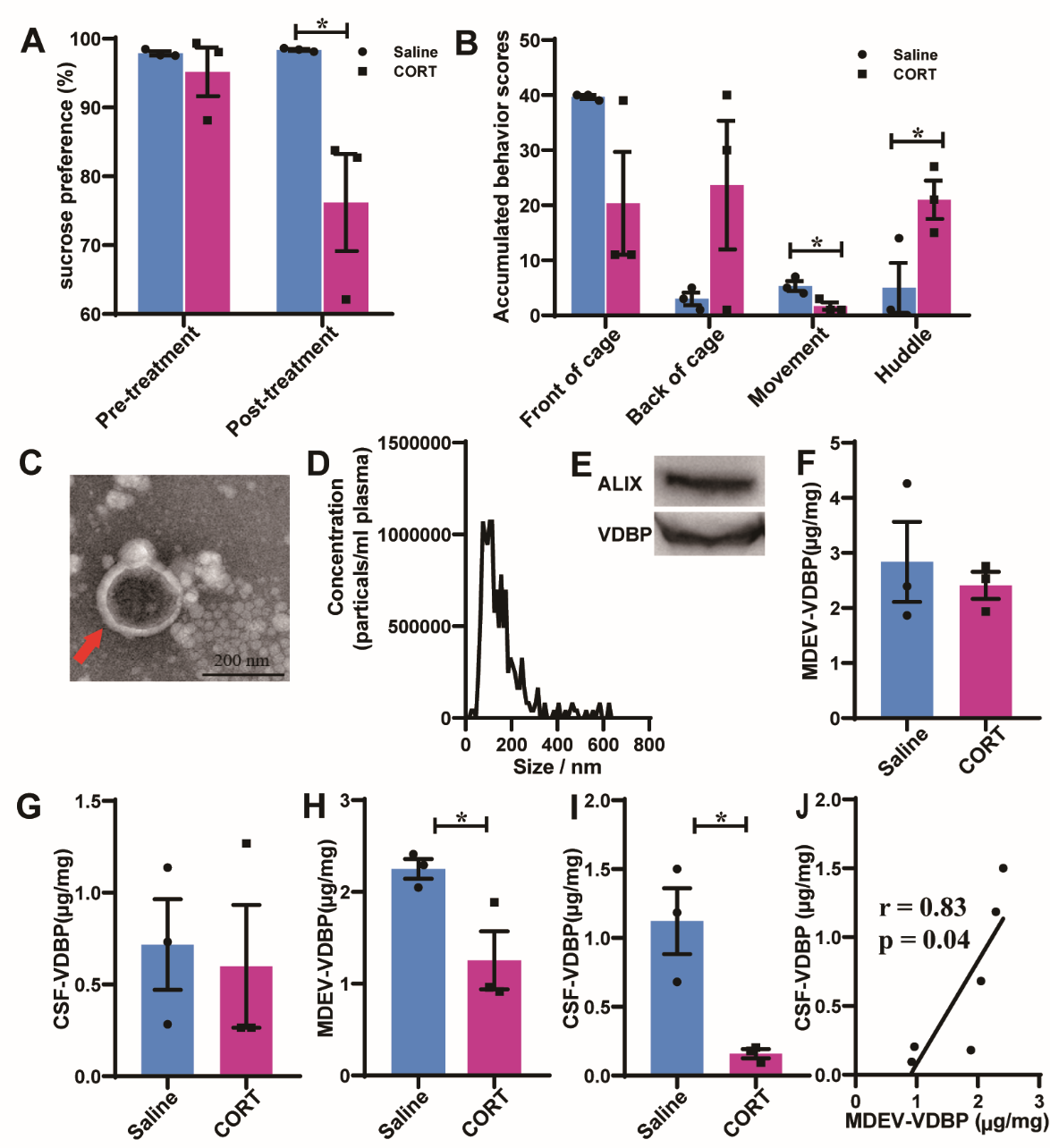
因为难以获得MDD患者脑组织(活检或尸检)甚至CSF,同时拟跨物种验证人类受试者研究发现,因此分别在非人灵长类和啮齿类抑郁样行为模式动物中验证血浆MDEV-VDBP水平与中枢VDBP水平一致性或相关性。首先在慢性糖皮质激素诱导的抑郁样行为恒河猴模型中,采用与人类受试者相同方法分离提取测定血浆MDEVs中VDBP水平,并完成抑郁样行为恒河猴CSF中VDBP水平测定,结果发现慢性糖皮质激素诱导的抑郁样行为恒河猴血浆MDEVs中VDBP水平和CSF中VDBP水平分别显著低于生理盐水干预组,差异均有显著性(MDEV-VDBP t=2.984,p=0.041;CSF-VDBP t=3.992,p=0.016),Pearson相关性分析显示,恒河猴血浆MDEVs中VDBP水平与CSF中VDBP水平呈显著正相关(r=0.83,p=0.04)(图3)。
图3 慢性糖皮质激素诱导的抑郁样行为恒河猴血浆MDEVs表征分析及其与CSF中VDBP水平一致性评估
继而,该研究测定了脂多糖(Lipopolysaccharide,LPS)急性诱导的抑郁样行为小鼠与灵长类DLPFC功能同源的脑区前边缘皮层(Prelimbic cortex,PrL)14小胶质细胞及血浆MDEVs中VDBP水平,结果发现,与生理盐水干预组相比,抑郁样行为模式小鼠血浆MDEVs中VDBP水平显著降低(t=3.082,p=0.007),而PrL区小胶质细胞中VDBP表达水平明显增加(t=2.354,p=0.043),两者呈显著负相关(r=-0.62,p=0.04)(图4)。
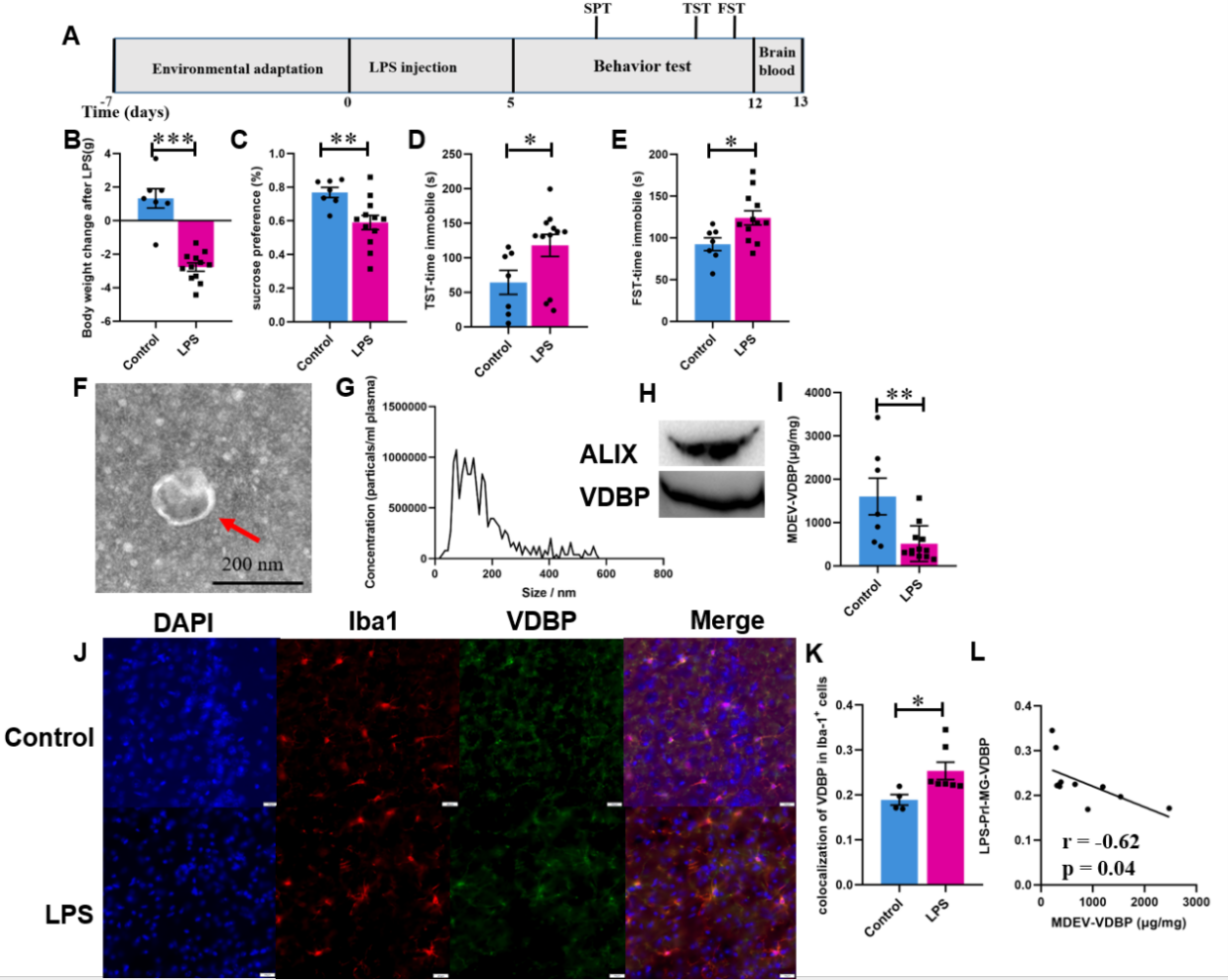
图4 LPS诱导的抑郁样行为小鼠血浆MDEVs和其PrL区小胶质细胞中VDBP水平
综上所述,该研究首次报道了MDD患者血浆三种主要BCDEVs中VDBP水平变化,与HC组相比,仅血浆MDEVs中VDBP水平选择性显著降低,并与患者抑郁症状严重度显著相关,具有较好的诊断效能。在慢性糖皮质激素诱导的抑郁样行为恒河猴和LPS诱导的抑郁样行为小鼠中,血浆MDEVs中减低的VDBP分别与恒河猴CSF中减低的VDBP或小鼠PrL区小胶质细胞内增高的VDBP水平显著相关,提示血浆MDEVs中VDBP水平可代表中枢成为有潜能的MDD诊断生物标志物。该研究的主要发现仍需在多个临床中心重复验证;其次,仍需克服困难验证MDD患者CSF或脑组织样本中VDBP水平及其与血浆MDEVs中VDBP水平相关性;此外,脑源性VDBP的合成代谢、生理功能尤其在MDD发病中的作用机制亟待阐明,获得充分的多层次上游研究实证后,才有可能最终确定VDBP作为MDD诊断生物标志物的潜能和干预新靶点。
参考文献:
Vitamin D-binding protein in plasma microglia-derived extracellular vesicles as a potential biomarker for major depressive disorder, Genes Dis. 2023 Apr 10;11(2):1009-1021. doi: 10.1016/j.gendis.2023.02.049. eCollection 2024 Mar.
原文链接
https://doi.org/10.1016/j.gendis.2023.02.049
外泌体资讯网 Genes & Diseases |张志珺课题组发现血浆小胶质细胞来源细胞外囊泡中维生素D结合蛋白可做为抑郁障碍诊断潜在生物标志物