溃疡性结肠炎(Ulcerative Colitis, UC)是一种反复发作的慢性非特异性肠道炎症,以腹痛,腹泻,粘液血便为主要临床特征,与克罗恩病(CD)同属于炎症性肠病(Inflammatory Bowel Diseases, IBD)。IBD主要好发于西方欧美等发达国家,但是随着生活方式的改变,我国UC的发病率在逐年增加。目前的UC的治疗依靠非靶向制剂如5-氨水杨酸盐、糖皮质激素和免疫抑制剂,和靶向生物制剂如英夫利昔单抗(IFX)、阿达木单抗(ADL)、Golimumab (GOLI)和Certolizumab pegol (CZP),以及JAK信号通路抑制剂(T ofacitinib)。这些治疗手段虽然在一定程度上能够减轻病理性肠道炎症,但是不能改变潜在的免疫紊乱或治愈该病,这样导致患者进入慢性,复发或者加重的状态甚至诱发结肠癌。最近研究表明可食用植物来源的类外泌体纳米囊泡(PDENs)在细胞间通讯中发挥重要作用,是新型疾病治疗的重要载体。通过合理开发口服天然植物纳米囊泡将开辟UC治疗新途径。
2023 年8月31日,深圳市人民医院消化内科研究团队与华南理工大学附属第二临床医学院广州市第一人民医院联合在国际TOP期刊Journal of Nanobiotechnology 杂志(中科院1区, IF:10.2)在线发表了题为“Edible exosome-like nanoparticles from portulaca oleracea L mitigate DSS-induced colitis via facilitating double-positive CD4+CD8+T cells expansion”的研究论文 (2023 Aug 31;21(1):309)。
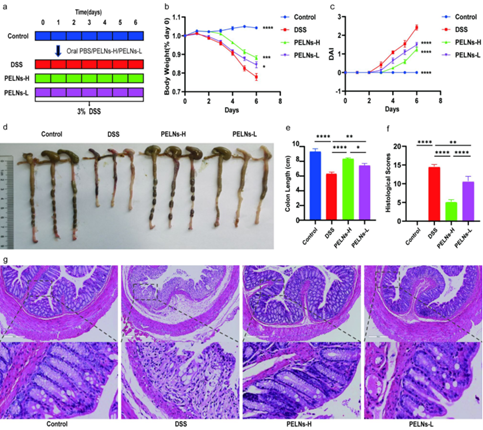
这项研究首次报道了马齿苋外泌体(PELNs)在治疗IBD中的显著效果并为IBD的新纳米药物开发和治疗提供了新的视角。结果显示,PELNs口服显著减轻了小鼠炎症症状,小鼠体重减轻程度小,DAI较小,结肠长度长于模型组,病理评分较小,HE染色结肠上皮炎性浸润少。
图1. PELNs口服治疗缓解小鼠炎症性肠病
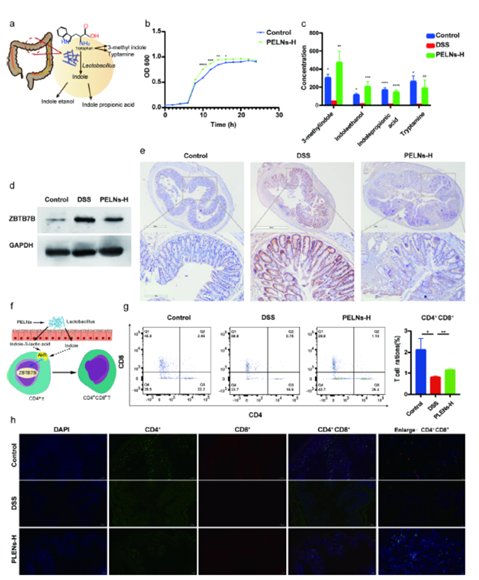
已有研究表明CD4+T细胞与UC的发病密切相关,Th1,Th2,Th17和Treg是其主要亚群。 CD4+T细胞诱发UC局部免疫反应的重要因素。该研究发现PELNs处理促进了罗伊式乳杆菌的生长和吲哚衍生物水平的升高,吲哚衍生物激活了常规CD4+ T细胞中的芳基烃受体(AhR),导致Zbtb7b的表达下调,将CD4+ T细胞重编程为双阳性CD4+CD8+T细胞(DP CD4+CD8+T细胞),并降低了促炎细胞因子的水平。
图2. PELNs 诱发CD4+ T细胞重编程为双阳性CD4+CD8+T细胞
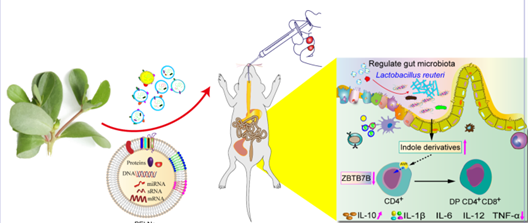
图3. 口服马齿苋来源的植物外泌体纳米颗粒(PELNs)治疗UC分子机制示意图
这项研究首次报到了PELNs在IBD中的治疗效果,并进一步提示了PELNs在炎症性疾病中的应用前景。PELNs通过提高肠道菌群的Lactobacillus reuteri,促进其代谢物吲哚衍生物的水平,从而激活传统CD4+ T细胞中的芳香烃受体(AhR),导致Zbtb7b的表达下调,引起CD4+ T细胞重编程为双阳性CD4+CD8+T细胞,并抑制促炎细胞因子的表达。
植物外泌体样纳米颗粒产率较高、提取周期短,来源广泛,有较低的免疫原性。此外,PELNs对健康组织的细胞毒性较小,具有优越的生物相容性,有望为理解IBD疾病的机制和开发创新药物提供契机。
相关论文发表在J Nanobiotechnology上, 研究生朱敏铮和徐豪明博士、梁宇杰博士、徐婧博士为本文共同第一作者,深圳市人民医院李德锋博士、王立生主任、姚君博士和广州市第一人民医院聂玉强教授为本论通讯作者。
参考文献:
Edible exosome-like nanoparticles from portulaca oleracea L mitigate DSS-induced colitis via facilitating double-positive CD4+CD8+T cells expansion. J Nanobiotechnology. 2023 Aug 31;21(1):309. doi: 10.1186/s12951-023-02065-0.
外泌体资讯网 J Nanobiotechnology |深圳市人民医院消化内科:马齿苋外泌体诱导CD4/CD8 T细胞缓解溃疡性结肠炎机制研究