细胞外泌体是细胞自然分泌的 30-150 nm 的膜结构纳米囊泡,在细胞间通信中发挥着重要作用,可将内容物(如蛋白质、脂质、核酸和代谢物)输送到受体细胞进行远距离调控。作为天然纳米载体,外泌体具有的高度生物相容性、生物屏障渗透性强、低毒性和低免疫原性等理想特性,使其成为潜在的药物递送工具。特定细胞来源的外泌体对部分细胞具有固有的靶向能力,但这一能力尚不足以满足靶向治疗的临床需求。而外泌体膜的表面修饰可以赋予其靶向能力,大大提高治疗效果。
近日,深圳市宝安区人民医院潘晓华教授和梁宇杰、刘启颂及李德锋博士共同对外泌体的脂质双层膜靶向修饰的原理和策略进行系统性阐述,总结了膜表面工程修饰策略,重点介绍了工程化外泌体在靶向治疗中的应用前景。文章于2023年9月16日刊发在Journal of Nanobiotechnology杂志上(中科院1区, IF:10.2)。
文章亮点:
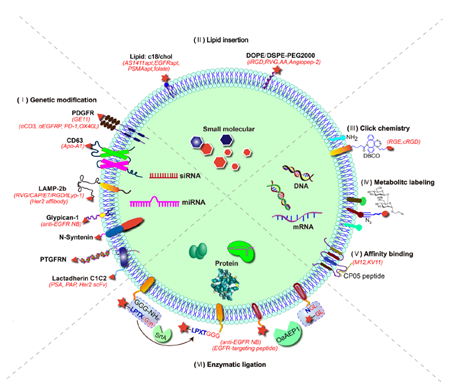
1.外泌体的膜表面工程化修饰用于靶向递送的策略:外泌体可通过膜蛋白基因工程改造、脂质插入、点击化学共价连接、非天然的糖代谢修饰、酶连接、亲和结合等多种方式将靶向特定器官/细胞/组织的配体修复到膜表面。
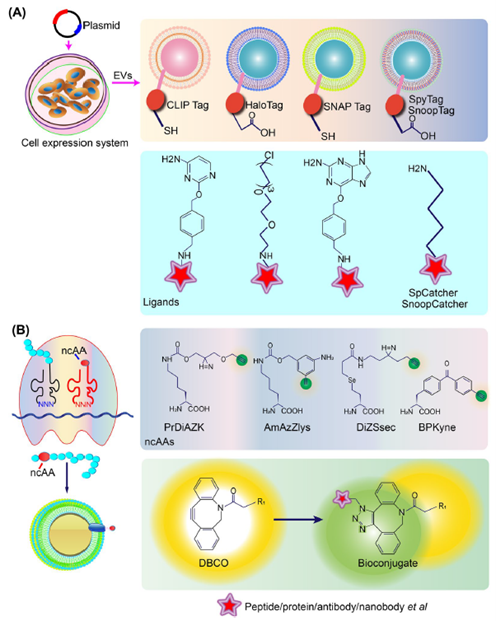
- 化学生物学改造外泌体膜表面的可行性方案:通过融合表达HaloTag、 SNAP-标签、CLIP-标签、ybbR 标签、SpyTag 和 SnoopTag 于外泌体膜表面,再根据每个标签的特异性配体进行表面化学反应共价偶联在外泌体膜上。另外也可以在外泌体膜蛋白中加入非典型氨基酸可促进叠氮-炔环化反应。然后将含有炔基的蛋白质与叠氮标记的靶向分子(如肽/蛋白质/抗体/纳米抗体等)进行化学连接。
- 总结与展望:
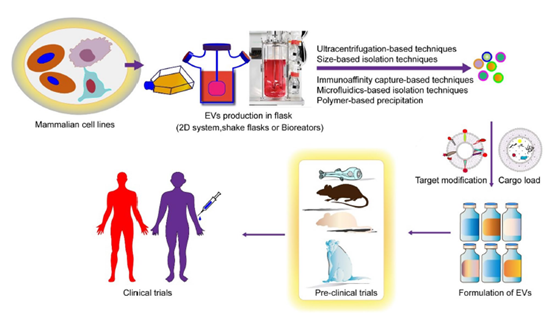
外泌体在药物递送和疾病治疗方面展现出巨大的潜力,有望成为下一代药物递送技术的突破口。作为一种新兴的药物或作为一种新兴的药物递送载体,外泌体在临床应用中仍面临诸多挑战。产量低和纯度低是阻碍外泌体广泛应用于临床的主要原因。尽管已被成功设计为针对多种受体的进行靶向治疗,但基于外泌体为的药物递送系统仍存在许多问题有待解决,例如靶向效率低。许多方法,包括基因工程疏水插入、化学修饰、脂质体融合、代谢工程和酶重塑等方法正在开发用于提高外泌体靶向效率。基因修饰细胞可引导外泌体膜表面展示特定的靶基团,但这类方法不适合难以转染的细胞类型,包括干细胞和红细胞。非基因方法包括基于脂质、糖类和蛋白质的修饰,可以规避与基因修饰相关的风险。
文章第一作者为刘启颂博士,深圳市宝安区人民医院潘晓华教授和梁宇杰博士为该文共同通讯作者。该项工作得到深圳市医疗三名工程项目(SZSM202106019)、广东省自然科学基金项目(2020A1515011107)和深圳市科创委基础研究面上项目(JCYJ20190809113815103)的部分资助。
参考文献:
Targeted therapy using engineered extracellular vesicles: principles and strategies for membrane modification. J Nanobiotechnol, 21, 334 (2023). https://doi.org/10.1186/s12951-023-02081-0
官网链接: https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-023-02081-0#citeas
外泌体资讯网 J Nanobiotechnol | 深圳市宝安区人民医院潘晓华教授团队:外泌体的脂质双层膜靶向修饰的原理和策略