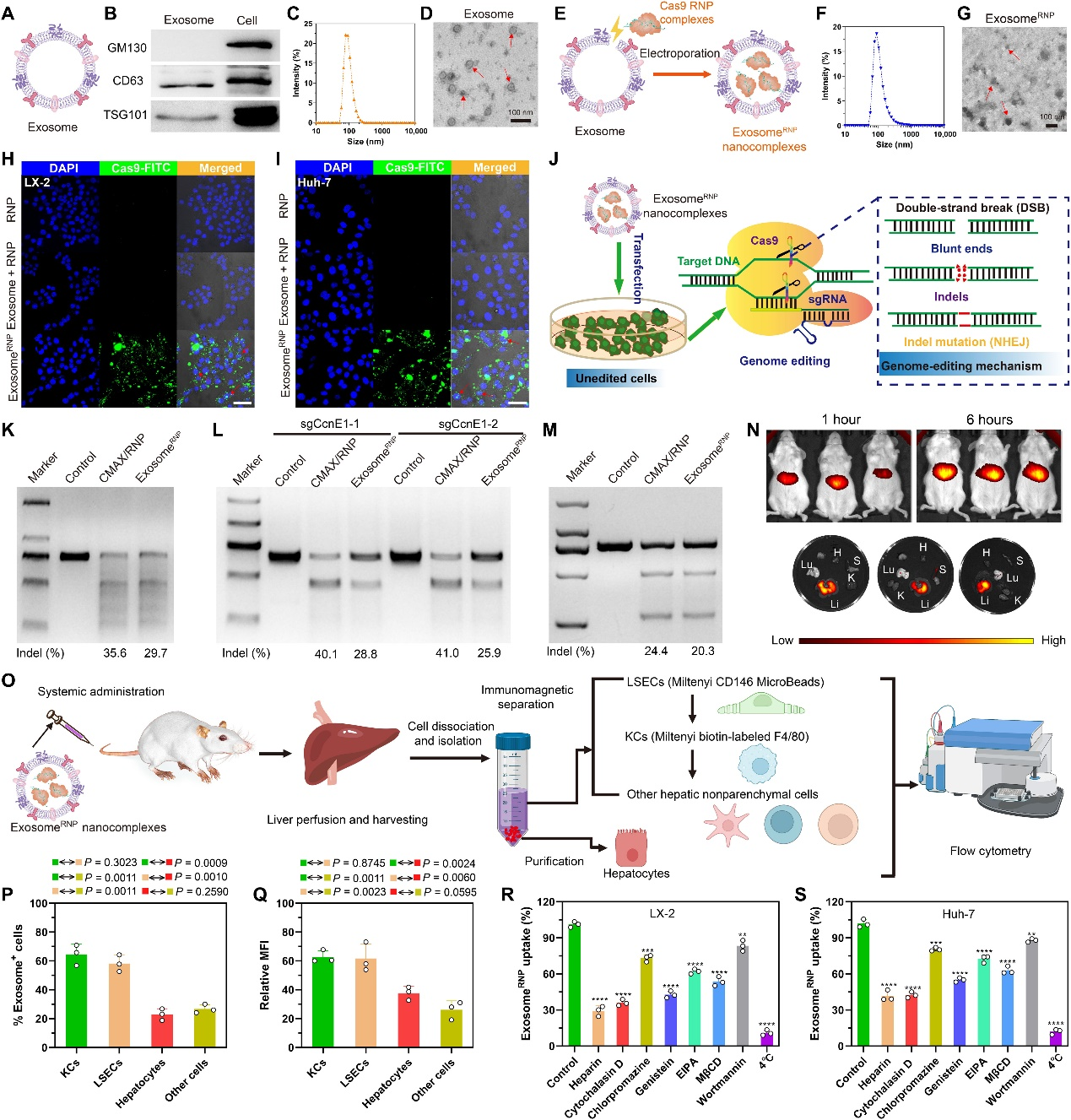
CRISPR/Cas9基因编辑治疗应用的困境——如何高效递送?
RNA引导的CRISPR/Cas9基因组编辑技术正被开发用于疾病治疗应用。CRISPR/Cas9介导的体细胞基因组编辑在动物模型中治疗各种遗传性疾病、甚至最近的转甲状腺素淀粉样变性临床试验中显示出巨大潜力。然而,CRISPR/Cas9系统的高效递送仍然具有挑战性。CRISPR/Cas9基因组编辑的主要障碍包括低递送效率和缺乏组织特异性,这严重限制了其临床应用。
对于治疗性基因组编辑,Cas9核酸酶和sgRNA必须被高效地递送到细胞内,最终进入细胞核。递送成分有三种选择:编码Cas9和sgRNA的质粒DNA、Cas9 mRNA加上sgRNA以及Cas9核糖核蛋白(RNP;与sgRNA结合的蛋白质复合物)。RNP递送避免了DNA和mRNA在转录和翻译过程中遇到的许多问题,使得编辑迅速发生,免疫反应低且脱靶活性弱。然而,由于RNP过大超过了病毒和非病毒载体的装载能力,RNP的治疗递送目前受到限制。此外,在制剂和血液循环过程中的降解或变性进一步阻碍了基于RNP的基因组编辑系统的治疗应用。迄今为止,对体内RNP递送的研究主要集中在两类载体上:基于聚合物的纳米颗粒和脂质体。尽管这些非病毒载体可以保护RNP免受血液中的降解,但系统给药后仍然难以实现组织特异性基因组编辑。
外泌体是潜在的CRISPR/Cas9递送载体
细胞自然释放的外泌体尺寸在40到160纳米之间。它们具有固有的生物相容性、运输能力、血液稳定性和可工程性,使其成为潜在的治疗用途的递送载体。与其他非病毒载体相比,外泌体引发的免疫原性低,毒性最小。外泌体具有同源组织靶向能力,这取决于源细胞的表型、组成和组织起源。最近,从转染CRISPR-Cas9质粒的特定细胞获得的内源性外泌体已成功用于将Cas9 RNP递送到靶细胞,表明外泌体在RNP递送方面具有很大潜力。然而,这些方法通常繁琐且耗时。几项研究表明,通过电穿孔法可以将质粒DNA或mRNA基因编辑器装载到纯化的外泌体中,这代表了一代新型基因组编辑载体,用于安全有效的治疗传递。然而,迄今为止尚未成功报道将大蛋白质(如RNP)通过电穿孔法装载到外泌体中。
肝脏是治疗基因递送的受欢迎的靶器官,因为它具有丰富的肝血流和纳米载体的高摄取和积累。此外,基因编辑是肝脏疾病的一种合理治疗方法,因为许多与肝脏相关的疾病与单个基因的突变高度相关。例如,美国食品和药物管理局在2017年批准了脂质纳米颗粒用于将小干扰RNA(siRNA)递送到肝脏,以治疗甲状腺激素诱导的淀粉样变性。然而,许多肝脏疾病,包括急性肝损伤、慢性肝纤维化和肝细胞癌(HCC),缺乏令人满意的治疗方法,因此迫切需要替代治疗选择。此外,针对肝脏疾病的肝定向基因治疗是另一个需要解决的问题。对于合成非病毒递送系统,将配体连接到其表面以增强其对特定受体的靶向能力可以实现靶向肝脏的能力,例如嫁接半乳糖或糖结合物以靶向非醛酸型糖蛋白受体。然而,这些方法会引发一定程度的免疫原性和肝毒性。与合成非病毒传递载体相比,天然存在的内源性治疗剂载体可以避免这些问题。由肝细胞产生的外泌体具有靶向肝脏的能力,这是由于其同源组织靶向能力,并且具有将CRISPR-Cas9 RNP在体内递送进行治疗性肝组织基因编辑的潜力。
外泌体递送CRISPR-Cas9 RNP用于肝脏靶向的疾病治疗
浙江大学刘祥瑞、平渊和周天华课题组合作在Science Advances杂志上发表文章,报道了外泌体递送CRISPR-Cas9 RNP用于肝脏靶向的疾病治疗研究成果。该研究开发了一种方法,可以将Cas9 RNP装载到肝星状细胞(HSCs; LX-2)的外泌体中,用于治疗不同的肝脏疾病。与使用原代细胞相比,使用免疫细胞系具有均匀性、可重复性和操作性等多个优点,可用于外泌体的生产。此外,作为非转化细胞,LX-2细胞的增殖速率和外泌体产生能力均优于免疫正常肝细胞(如THLE-2)。通过优化的电穿孔法将Cas9 RNP装载到纯化的LX-2外泌体中,获得了基因编辑递送系统exosomeRNP(图1)。正如预期的那样,exosomeRNP在肝损伤、肝纤维化和原位HCC小鼠模型上显示出强大的肝特异性基因编辑活性和强大的治疗效果。exosomeRNP代表了一种新一代内源性囊泡,用于高效递送Cas9 RNP,可以产生肝特异性、强大的基因编辑,并实现肝脏疾病的精准治疗 。
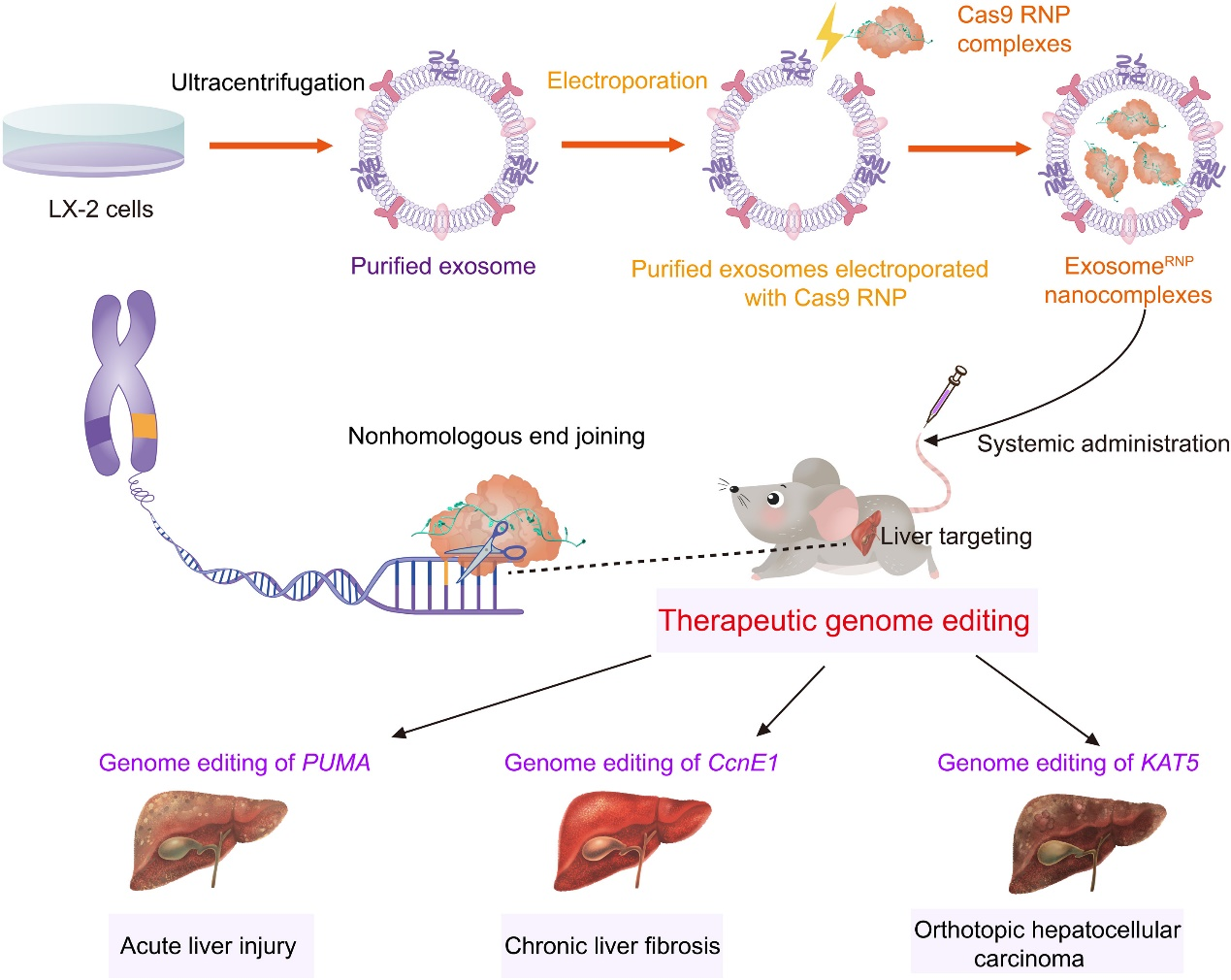 图1、外泌体用于体内递送Cas9 RNP治疗肝脏疾病的示意图。ExosomeRNP通过分别靶向PUMA、CcnE1和KAT5,在急性肝损伤、慢性肝纤维化和原位HCC小鼠模型中显示出强大的治疗潜力。
图1、外泌体用于体内递送Cas9 RNP治疗肝脏疾病的示意图。ExosomeRNP通过分别靶向PUMA、CcnE1和KAT5,在急性肝损伤、慢性肝纤维化和原位HCC小鼠模型中显示出强大的治疗潜力。
Exosome和exosomeRNP的制备
为了制备去除外泌体的胎牛血清(FBS),将FBS在100,000g、4°C条件下超速离心20小时,然后通过100纳米过滤器过滤。对于外泌体的分离,将LX-2细胞培养在含有去除外泌体的FBS的DMEM中。然后,收集培养基并分别以800g离心5分钟,3000g离心15分钟和10,000g离心1小时。然后,将得到的上清液在SW32 Ti转子(Beckman)中以100,000g、4°C条件下超速离心2小时。然后,将纯化的外泌体沉淀物在冷PBS中重新悬浮以再次超速离心。对于电穿孔,将沉淀物在电穿孔缓冲液[1.15 mM potassium phosphate (pH 7.2), 25 mM potassium chloride, and 21% OptiPrep working solution]中重新悬浮。然后,将悬浮的外泌体通过0.22微米过滤器过滤。为了制备外泌体RNP复合物,Cas9蛋白与sgRNA混合形成RNP复合物。然后,以1:5的重量比向外泌体中添加RNP复合物,然后使用Gene Pulser Xcell(Bio-Rad)电穿孔仪电穿孔混合物以形成外泌体RNP复合物。电穿孔后,将外泌体在100,000g、4°C条件下超速离心2小时,然后沉淀物在冷PBS溶液中重新悬浮。
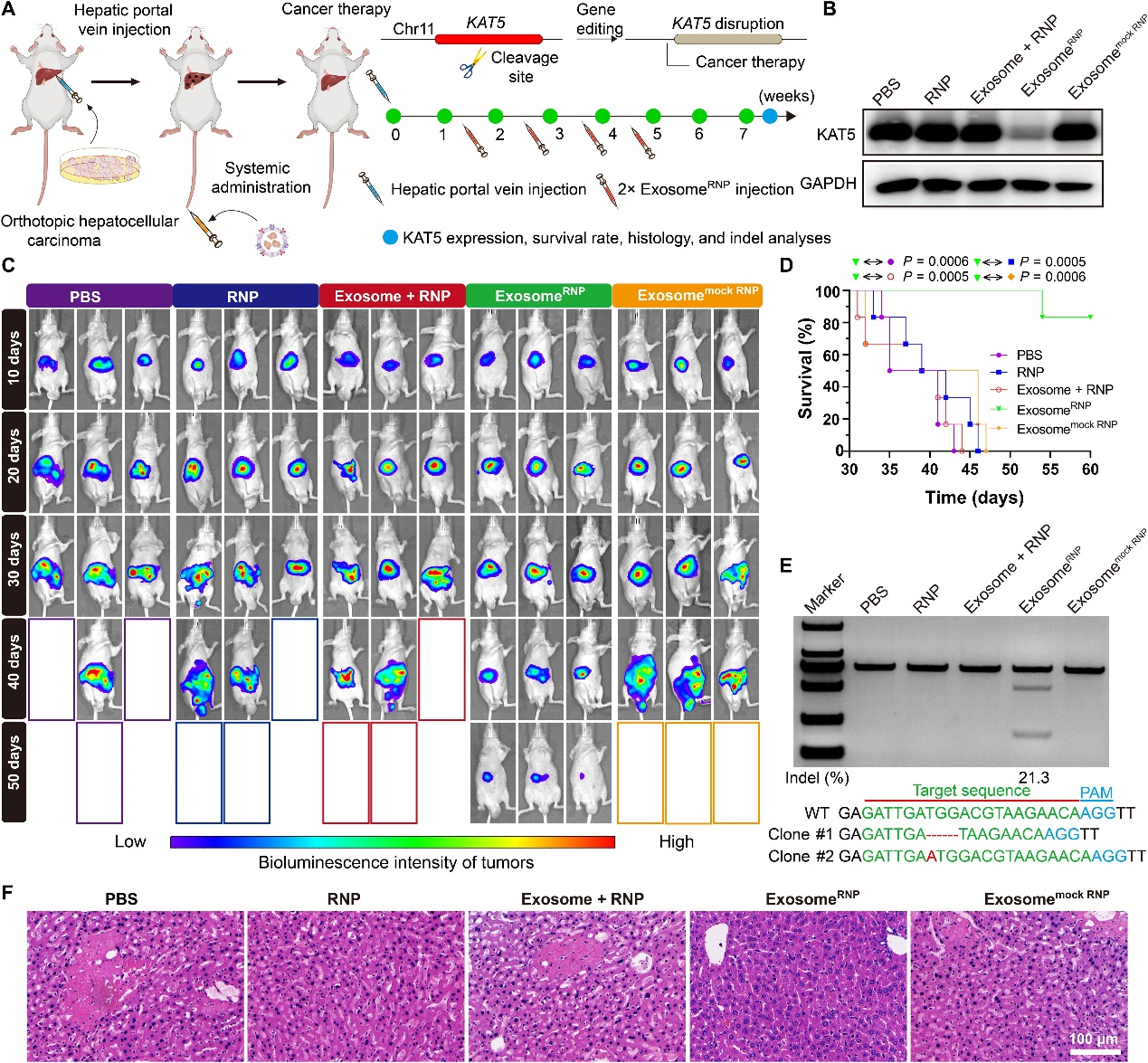
exosomeRNP的治疗应用——靶向KAT5的外泌体RNP可改善原位HCC
由于高复发率和缺乏有效的治疗方法,HCC通常与患者的生存率较低相关。近年来,包括CRISPR技术在内的新的HCC治疗方法受到了广泛关注。K(赖氨酸)乙酰转移酶5(KAT5)对HCC的生长至关重要,而破坏KAT5则能够抑制体外和体内的肿瘤生长。因此,该研究设计了针对KAT5的sgRNA,并开发了exosomeRNP来治疗HCC。在HCC的原位小鼠模型中测试了exosomeRNP靶向KAT5的治疗效果。在肝门静脉注射荧光素转染的Huh-7(Huh-7-luci)细胞一周后,小鼠被静脉注射不同的治疗方案(PBS、RNP、exosome + RNP、exosomeRNP和exosomemock RNP),并使用体内生物发光成像评估肿瘤生长。与其他治疗方案相比,接受exosomeRNP靶向KAT5治疗的小鼠显示出最小的肿瘤体积和最弱的生物发光强度,而其他治疗方案则没有明显的抑制作用。此外,蛋白质分析表明,在exosomeRNP治疗后,KAT5表达水平显著降低,而其他治疗方案则没有变化。此外,与其他组相比,接受exosomeRNP治疗的小鼠的存活时间也显著延长。T7E1和Sanger测序进一步验证了体内基因组编辑,在肝组织中发现了KAT5位点的显著基因组紊乱(21.3%插入/缺失突变)。组织学染色也观察到类似趋势。总之,这些结果表明,针对KAT5的exosomeRNP在原位HCC中产生了出色的抗癌活性。
(A)用于体内递送Cas9 RNP治疗原位HCC的外泌体示意图。Huh-7-luci细胞通过肝门静脉注射给药,外泌体RNP复合物通过尾静脉注射。(B) KAT5表达的蛋白质印迹分析。(C) 整只小鼠中原位HCC的体内荧光素酶表达。(D)治疗后的存活率。(E)治疗后通过T7E1测定从肝组织中检测到的插入缺失突变的频率。(F)小鼠肝脏切片的H&E染色。
总结
该研究开发了一种基于外泌体的纳米平台,实现了RNP基因组编辑治疗肝病。通过电穿孔,RNP可以有效地装载到LX-2衍生的外泌体中,并通过外泌体RNP特异性地递送到肝脏。通过靶向PUMA、CcnE1和KAT5,外泌体RNP在急性肝损伤、慢性肝纤维化和HCC小鼠模型中表现出强大的治疗潜力。该发现不仅提供了一种克服RNP递送障碍的实用策略,而且为肝病的精确和组织特异性基因治疗开辟了一个有前途的途径。
参考文献:
Wan T, Zhong J, Pan Q, Zhou T, Ping Y, Liu X. Exosome-mediated delivery of Cas9 ribonucleoprotein complexes for tissue-specific gene therapy of liver diseases. Sci Adv. 2022 Sep 16;8(37):eabp9435. doi: 10.1126/sciadv.abp9435. Epub 2022 Sep 14. PMID: 36103526; PMCID: PMC9473578.