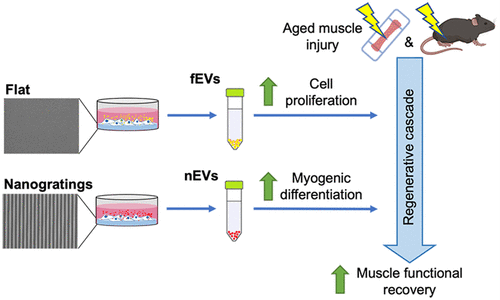
骨骼肌再生依赖于肌肉干/祖细胞(MPCs)从激活、增殖、分化的严格时间调控的谱系进展。然而,随着年龄的增长,MPC谱系的进展被中断和延迟,最终导致肌肉再生受损。细胞外囊泡(EVs)作为促进组织再生的新一代治疗手段引起了广泛的关注。作为临床转化的下一步,需要操纵EV进而用于靶向下游细胞。来自美国Schoen Adams Research Institute的研究人员开发了一种工程化策略,利用纳米形貌线索来调整EV的治疗潜力,在平面基质(fEV)上培养的年轻MPCs释放的EV促进了老年MPCs的增殖,而在纳米光栅(nEV)上培养的MPCs释放的EV促进了成肌分化。该方案在老年小鼠体内得到了进一步的验证,在MPC增殖扩张阶段用fEV治疗老年小鼠,然后在分化阶段用nEV治疗老年小鼠,显示出与年轻小鼠相当的功能再生水平。相关内容以“Nanotopographical Cues Tune the Therapeutic Potential of Extracellular Vesicles for the Treatment of Aged Skeletal Muscle Injuries”为题在线发表于10月5日国际知名纳米材料学术期刊ACS Nano上。
骨骼肌再生是一个复杂而有效的过程,它依赖于肌肉干细胞/祖细胞(muscle stem/progenitor cells,MPCs)的活性。在肌肉再生过程中,MPCs经历了一个精心安排的谱系进展过程,从静止到激活、增殖和成肌分化,形成肌纤维。然而,随着年龄的增长,每个阶段的MPC反应都会受到损害,最终导致肌肉再生减少。基于细胞的策略,如细胞移植,已被用于促进疾病或衰老背景下的骨骼肌修复。例如,移植年轻MPCs或年轻化后的老年MPCs可改善急性损伤后老年肌肉的修复。然而,尽管结果很有希望,但基于细胞的策略的临床应用受到限制,因为体外细胞扩增通常会导致细胞再生能力的显著降低。因此,人们越来越重视分离细胞疗法的促再生作用,同时减轻其局限性。为此,越来越多的证据表明,移植细胞的大部分有益作用是由旁分泌因子介导的,这表明利用这些旁分泌因子可能是细胞移植的一种有希望的替代方法。
在这些旁分泌因子中,细胞外囊泡(EVs)显示出促进组织再生的潜力。EVs是几乎所有类型的细胞都分泌的膜结合囊泡。EV含有蛋白质、脂质和核酸形式的分子信息,这些信息可以转移到受体细胞,指导细胞反应和行为。EV有效地将其货物转移到受体细胞的能力,使EV成为再生医学中有前途的无细胞治疗工具。例如,不同类型的干细胞(如间充质干细胞MSCs和MPCs)释放的EV可促进多种组织的再生,包括皮肤、骨骼和骨骼肌。此外,研究表明,EV的治疗潜力依赖于它们的分子货物,这与起源细胞来源的表型密切相关。例如,通过分化型而非增殖型的人MPCs释放的EV可改善5周龄小鼠的骨骼肌再生。因此,当产生功能性EV时,调节原始细胞表型是一种很有前途的方法来操纵EV的治疗性能。
受原生细胞外基质的纳米级结构特征的启发,许多研究团队都在研究具有不同纳米形貌的基质,以控制组织工程和再生医学中的细胞行为。纳米光栅或定向纳米纤维已被广泛用于诱导MSCs或成肌细胞的定向和分化,以驱动体外肌管形成和促进体内肌肉再生。虽然这些研究大多集中在研究纳米形貌线索如何直接影响细胞反应,但很少有人探索纳米形貌对EV生物分子货物的潜在影响。
在这项研究中,研究人员使用纳米形貌线索来调节EV治疗老年骨骼肌损伤的治疗潜力。研究证明纳米光栅促进MPC肌分化和肌管形成,与先前的研究一致。进一步发现,细胞在纳米拓扑基质上增强的肌源性分化依赖于EV的分泌和摄取。当直接比较从平面培养(flat surfaces)的年轻MPCs(fEVs)和纳米光栅(nanogratings)中(nEV)分离的EV的下游效应时,研究发现每种EV群体对受体衰老细胞的影响都不同。也就是说,fEV优先促进老年MPC增殖,而nEV促进肌源性分化。
利用这些信息,利用高通量生物工程3D肌肉老化模型来优化fEV和nEV的输送和时间。研究发现,只有先给药fEV,然后给药nEV才能改善工程肌肉的肌肉再生。结果显示,在MPC增殖扩张阶段(即损伤后1天)先序贯给药fEV,然后在MPC分化阶段(即损伤后3天)给药nEV,明显比单独或混合给药fEV和nEV更能促进衰老肌肉的再生。在体内进一步验证了序贯EV治疗策略的有益效果,证明了肌纤维大小的增加和功能恢复的改善。总的来说,这项研究证明了纳米形貌线索调节EV治疗潜力的能力,并强调了优化EV给药策略用于加速衰老骨骼肌再生的重要性。
参考文献:Nanotopographical Cues Tune the Therapeutic Potential of Extracellular Vesicles for the Treatment of Aged Skeletal Muscle Injuries. ACS Nano. 2023 Oct 5. doi: 10.1021/acsnano.3c02269.