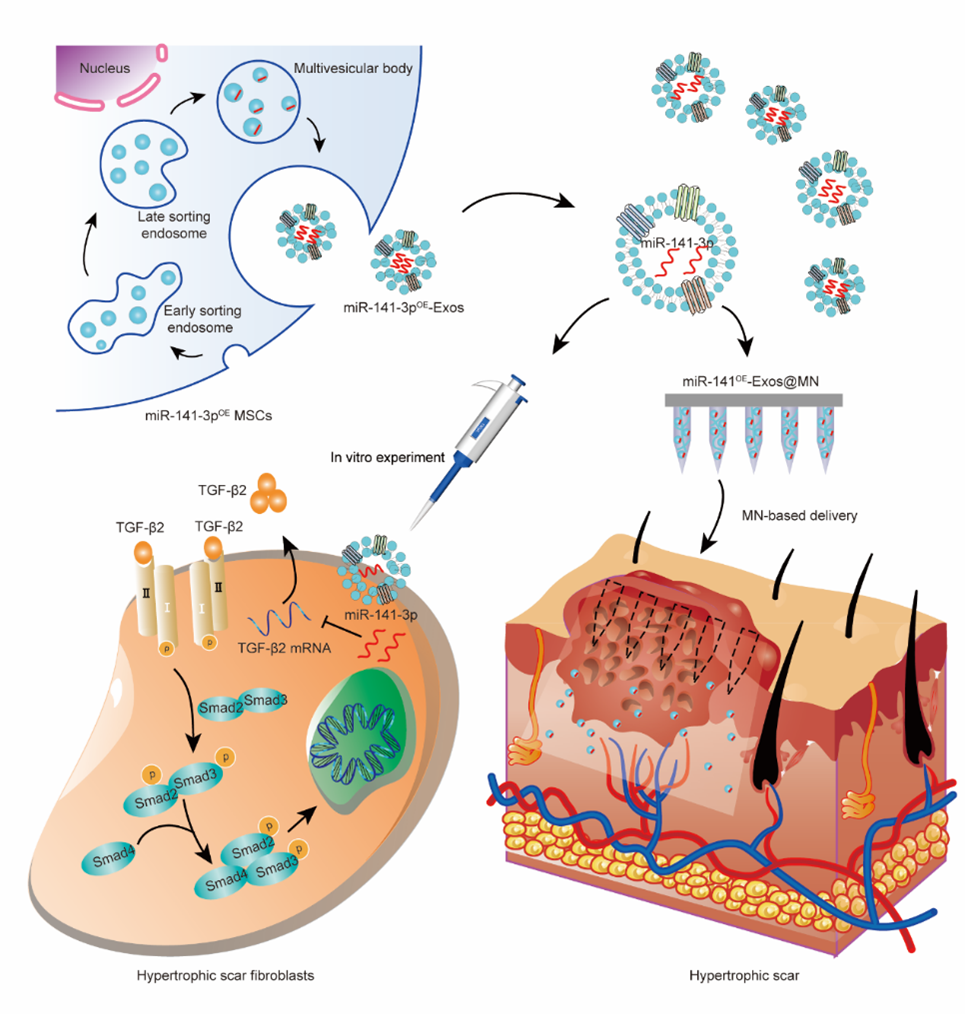
增生性瘢痕(HS)是一种常见的纤维增生性疾病,由皮肤深度损伤后创面非正常愈合引起,现有治疗方法很难达到令人满意的效果。间充质干细胞来源外泌体作为天然纳米载体,可携带多种小分子活性物质,特别是对RNA类药物具有高效保护作用。微针作为新一代的透皮给药技术,以精确、无痛、微创方式实现药物的持续释放。因此,miRNA功能化外泌体负载于可溶性微针有望为HS治疗提供新的希望。近日,SMALL在线发表了解放军总医院/中国医学科学院张翠萍研究员、付小兵院士以及中山大学附属第七医院(深圳)李海红研究员的研究工作“MiR-141-3p-Functionalized Exosomes Loaded in Dissolvable Microneedle Arrays for Hypertrophic Scar Treatment”(2023 Sep 18; e2305374. doi: 10.1002/smll. 202305374)。该研究报道miR-141-3p在皮肤瘢痕组织和增生性瘢痕成纤维细胞中表达下调,高表达miR-141-3p的工程化外泌体可以抑制瘢痕成纤维细胞的病理生物学行为,将miR-141-3pOE-Exos负载于可溶性微针(DMNAs),miR-141OE-Exos@DMNAs能有效降低HS的厚度,改善成纤维细胞分布和胶原纤维排列。
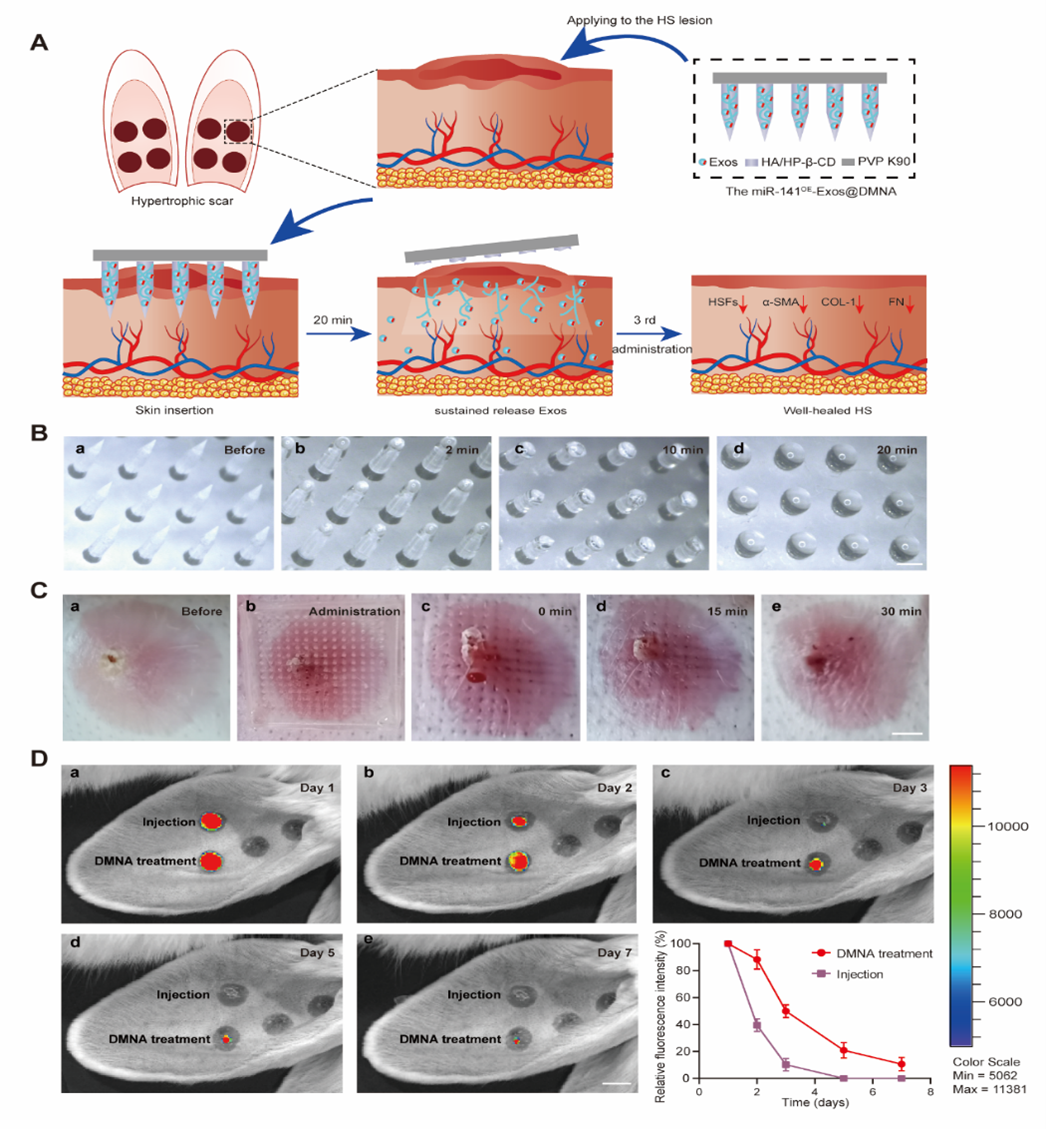
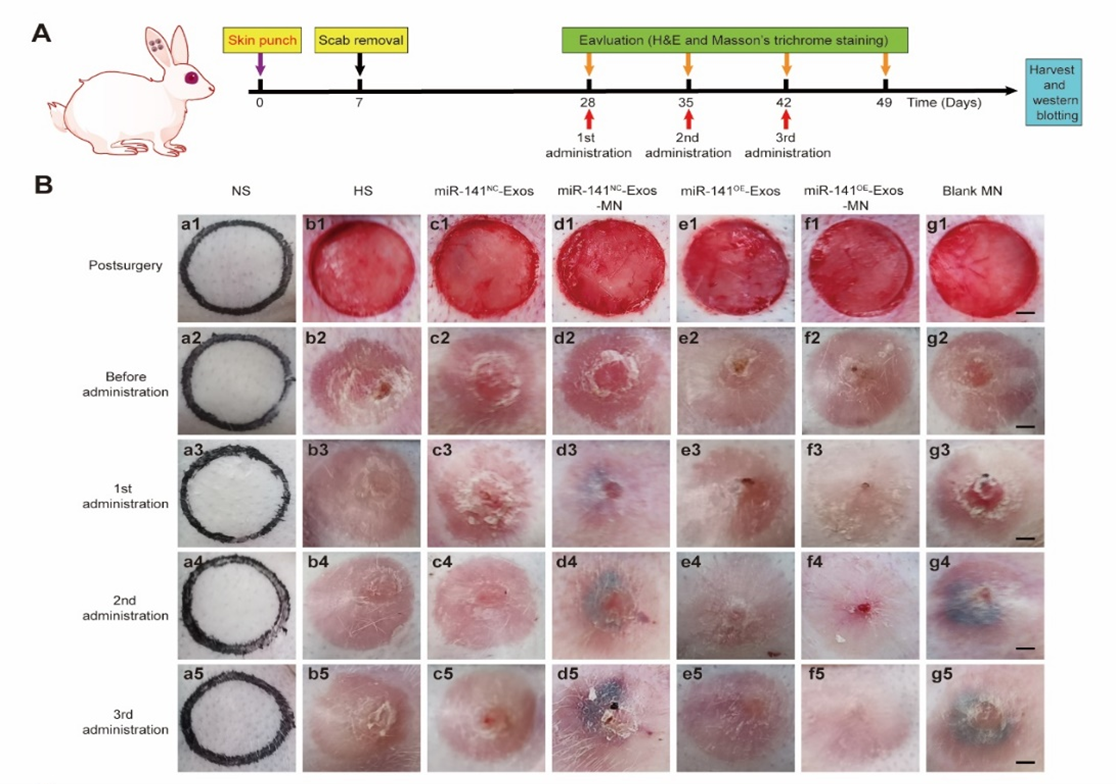
在深度或大面积皮肤损伤后,成纤维细胞的异常增殖和细胞外基质的过度沉积是HS形成的重要原因。越来越多的研究表明miRNA是纤维化的重要调节因子。然而,由于其不稳定和对降解的敏感性,miRNA很难转移进入靶细胞。外泌体是目前被公认的理想治疗分子载体,因为它们能够保护所携带的分子免受免疫清除与血清蛋白酶的降解。但由于天然外泌体含有的治疗成分偏低,治疗效果有限,因此miRNA功能化外泌体有可能成为治疗瘢痕的有效途径。外泌体治疗HS的效果取决于皮肤的穿透深度,常规方法多点注射会导致外泌体分布不均匀、半衰期短、局部滞留率低等问题,DMNAs作为新一代的透皮给药方式,可实现外泌体的持续性控释。而且目前,使用DMNA递送外泌体用于HS治疗尚无相关报道。图1 DMNA递送miR-141-3p功能化外泌体用于HS治疗示意图在该研究中,首先通过现有文献数据及体外实验确定miR-141-3p是一种潜在的HS治疗剂。解析miR-141-3p作用的机制可能是抑制TGF-b2/Smad信号通路。将miR-141-3p在脂肪干细胞中过表达制备miR-141-3p功能化外泌体,结果表明,miR-141-3pOE-Exos在体外能有效抑制瘢痕成纤维细胞的增殖、迁移和分泌功能。将miR-141-3pOE-Exos包载于DMNAs用于兔耳瘢痕模型,MiR-141OE-Exos@DMNAs有效减少瘢痕局部胶原的过度沉积,改善成纤维细胞分布和胶原纤维排列,从而减少HS的厚度。图2 兔耳模型miR-141OE-Exos@DMNAs插入及缓释能力验证图3 miR-141OE-Exos@DMNAs在体内抑制兔耳HS的形成综上所述,该研究报道了miR-141-3p功能化外泌体在体外通过下调TGF-β2/Smad途径抑制瘢痕成纤维细胞的增殖、迁移和肌成纤维细胞转分化。miR-141OE-Exos@DMNAs在体内通过下调TGF-β2/Smad通路,有效降低HS厚度,改善成纤维细胞分布和胶原纤维排列。、MiR-141-3p-Functionalized Exosomes Loaded in Dissolvable Microneedle Arrays for Hypertrophic Scar Treatment, Small. 2023 Sep 18:e2305374. doi: 10.1002/smll.202305374. 外泌体资讯网 SMALL|张翠萍研究员、付小兵院士以及李海红研究员:miR-141-3p功能化外泌体负载于可溶性微针用于治疗增生性瘢痕