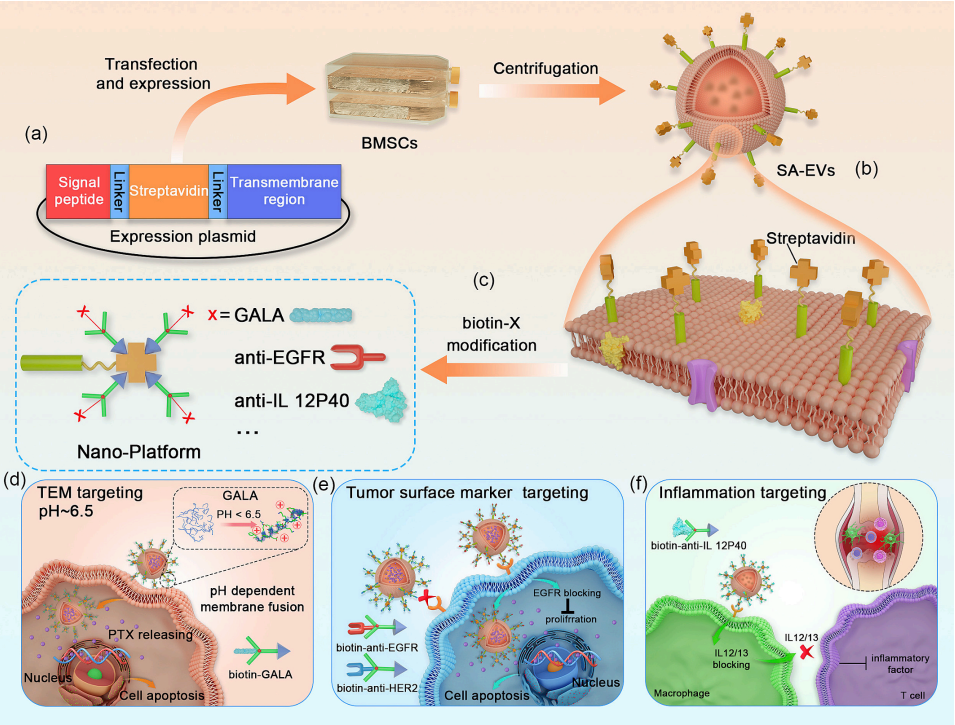
细胞外囊泡(EV)因其理想的尺寸范围和内在生物相容性而成为有前景的治疗载体。然而,有限的靶向能力使EV的临床转化受阻。任何药物载体的临床转化,不仅需要自身的结构优势和低免疫原性,更重要的是需要其多场景使用的能力。链霉亲和素和生物素系统是一对强亲和力的分子,它们已广泛用于体外和体内的检测、标记等领域。但是链霉亲和素和生物素系统是否能用于提高EV作为药物载体的靶向性有待探究。因此有必要开发具有多功能的EV靶向平台加速EV的临床转化研究。
近期,四川大学华西口腔医院头颈肿瘤外科朱桂全教授团队在Journal of Controlled Release 在线发表了题为“Engineered mesenchymal stem cell-derived extracellular vesicles constitute a versatile platform for targeted drug delivery”的研究论文(DOI:10.1016/j.jconrel.2023.09.037.)四川大学华西口腔医院孟婉蓉博士为第一作者,朱桂全教授为通讯作者。
作者通过基因工程融合跨膜肽和天然链霉亲和素序列,并验证了游离链霉亲和素表达于骨髓间充质干细胞(BMSC)膜外侧。从这些细胞中获得了过表达链霉亲和素的EVs(SA-EVs),且与生物素具有很高的亲和力。EV蛋白组学揭示了工程化修饰后的SA-EVs蛋白组成稳定,不影响70种EV蛋白表达。作者利用此EV纳米平台实现了缺氧口腔鳞癌,乳腺癌,类风湿性关节炎的治疗。
生物素化的pH敏感GALA结合的SA-EVs在缺氧微环境中实现了对口腔鳞状细胞癌的靶向性化疗药物递送。生物素化的anti-EGFR和anti-HER2结合的SA-EVs能够特异性地将化疗药物递送到分别为EGFR+和HER2+的乳腺癌。生物素化的anti-IL12/IL23结合的SA-EVs特异性地积聚在关节炎患处,并缓解炎症。这些靶向修饰的代表性应用场景表明,使用不同的生物素化分子,SA过表达BMSC-EVs可以赋予不同的靶向性。以上研究表明工程化修饰后的BMSC衍生的EVs可作为理想的药物输送工具,利用生物素和链霉亲和素实现个性化靶向治疗。
虽然EVs作为一种新型药物输送载体具有巨大潜力,进一步的临床前研究应该关注其产量、储存和GMP生产等。因此团队将继续进行研究并突破这些瓶颈,以确保SA-EVs的成功临床应用。
参考文献:
Engineered mesenchymal stem cell-derived extracellular vesicles constitute a versatile platform for targeted drug delivery. J Control Release. 2023 Sep 28; 363:235-252.
外泌体资讯网 J Control Release | 四川大学华西口腔医院朱桂全:工程化间充质干细胞来源的EV构成的靶向药物递送的多功能平台