胰腺导管腺癌(PDAC)肿瘤携带多种基因突变,对治疗反应不佳。目前存在一种未满足的需求,即需要药物载体,可以靶向将多个基因载荷传递到高实体肿瘤负担的PDAC。近日,美国俄亥俄州立大学的L. James Lee教授、北京大学深圳研究生院的Andrew S Lee教授、台湾成功大学沈延盛医师等团队合作在Nature Communications杂志上发表文章,报道了用于晚期胰腺癌治疗研究的双靶向细胞外囊泡。该研究工作提供了一种临床可行且可扩展的方法,用于生产大量EV以递送多个基因载荷到大型实体肿瘤。
PDAC难以治疗,5年生存率低于10%。大于90%的PDAC存在GTP酶KRAS突变,而目前唯一临床可用的针对RAS家族的药物是针对非小细胞肺癌中的KRASG12C突变的抑制剂(LUMAKRAS™,sotorasib)。大多数患者在诊断时都是晚期不可切除的肿瘤,这些肿瘤携带多个基因突变。在这些情况中,70%的病例中,KRASG12D突变与突变的TP53肿瘤抑制因子同时出现。因此,需要新的治疗方法来针对PDAC中的多个突变。然而,将多种基因药物精确地输送到这种晚期肿瘤是一个巨大的挑战。脂质体纳米粒子(LNPs)虽然很受欢迎,但不适用于固体肿瘤治疗,因为它们不能很好地穿透组织或穿越生理屏障,而病毒传递效率高但免疫原性高。
细胞外囊泡(EVs),如外泌体和微囊泡,是基因递送的有吸引力的替代品,因为它们具有低免疫原性与细胞毒性,并且可以穿过生理屏障。含有外源性KRASG12D沉默RNA(siKRASG12D)的外泌体已被证明可以抑制小型、非晚期、正位PANC-1 PDAC小鼠肿瘤。作者以前曾使用携带内源性磷酸酯酶和张力同源物(PTEN)mRNA的EVs来减缓小型胶质母细胞瘤小鼠的肿瘤生长(https://www.exosomemed.com/6581.html )。虽然有希望,但为了使这些基于EVs的治疗方法具有临床相关性,它们必须能够携带多个基因载荷,精确地靶向、穿透和治疗大型实体PDAC肿瘤和转移。此外,EV生产必须可扩展且易于获得。目前的方法包括将合成RNA插入预分离的EVs中,这很难装载大型mRNA载荷,或者基因修饰供体细胞,这很复杂并面临着基因组整合的离靶风险。
该研究报道了易于扩展的双重靶向治疗性EV(dtEV),其包含高拷贝数的TP53 mRNA或siKRASG12D,可以抑制大型实体PDAC肿瘤。该dtEV表面包含一个CD64蛋白,该蛋白在N-末端经过工程改造,带有一个CKAAKNK(CK)组织靶向肽,可靶向胰腺肿瘤组织。这种工程蛋白(CD64CK)作为通用锚点,与任何临床可用的治疗性人源化单克隆抗体(hmAb)具有高亲和力,以形成EV表面上的第二个靶向配体。使用人源化抗受体酪氨酸激酶样孤儿受体1(αROR1)抗体作为第二个配体,以靶向肿瘤上常见但正常组织上不常见的ROR1受体。使用质粒DNA分别产生CD64CK蛋白和TP53 mRNA或siKRASG12D,并通过Transwell®基于不对称细胞电穿孔(TACE)逐步传递到小鼠胚胎成纤维细胞(MEF)或hBMSCs中——一种临床可访问且可扩展的方法,使用经济实惠的Transwell®插入件。通过TACE逐步传递CD64CK质粒DNA和TP53或siKRASG12D质粒DNA促进释放含有高TP53 mRNA的EV和EV表面上的CD64CK蛋白。与人源化αROR1抗体亲和结合后,该dtEV与一线化疗药物吉西他滨(GEM)一起抑制了大型原位PANC-1和患者来源的异种移植(PDX)肿瘤和转移,并通过强大的基因调控、癌细胞周期阻滞和减少化学药物耐药性延长了动物存活时间。双重靶向促进了受体介导的组织穿透、肿瘤细胞摄取和EV细胞质RNA释放。
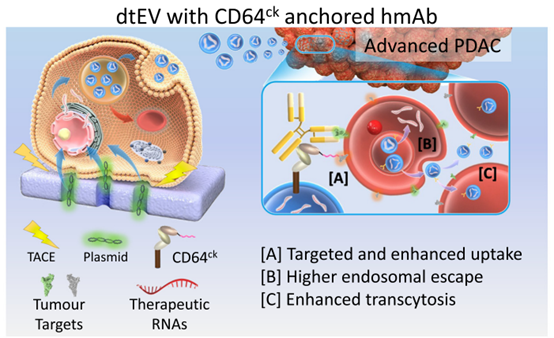
Transwell®插入物上的供体细胞通过Transwell®孔(1μm)中的高电场强度从插入物下方转染质粒DNA。从质粒转录的货物RNA驻留在多囊体内的内腔泡(ILV)中。TACE促进了含有治疗性RNA和CD64CK蛋白的dtEVs的分泌。临床可用的人源化单克隆抗体(hmAb)以CD64CK作为第二个靶向配体。hmAb和CK肽双靶向EV(dtEV)提供[A]特异性肿瘤靶向和亲和力增强的癌细胞摄取(更好的内吞作用),[B]改善治疗性RNA的细胞质释放(更高的内体逃逸),以及[C]通过CD64CK / hmAb与癌细胞膜上的受体相互作用,具有优越的组织穿透性(更强的横穿作用)。
总之,该研究报告了一种双重靶向的细胞外囊泡(dtEV),它携带高负载的治疗性RNA,可以有效抑制小鼠中的大PDAC肿瘤。EV表面含有CD64蛋白,具有组织靶向肽和人源化单克隆抗体。通过Transwell®-基于不对称细胞电穿孔顺序转染编码感兴趣RNA和蛋白质的质粒DNA的细胞释放大量靶向EV,RNA负载高。与低剂量化疗药物吉西他滨一起,dtEV可以抑制小鼠中大的原位PANC-1和患者来源的异种移植肿瘤和转移,并延长动物的生存时间。该工作证明了一种简单、低成本的方法来生产大量携带高负载遗传物质的定向EV,可以有效地治疗动物模型中的晚期癌症。
参考文献:
Chiang CL, Ma Y, Hou YC, Pan J, Chen SY, Chien MH, Zhang ZX, Hsu WH, Wang X, Zhang J, Li H, Sun L, Fallen S, Lee I, Chen XY, Chu YS, Zhang C, Cheng TS, Jiang W, Kim BYS, Reategui E, Lee R, Yuan Y, Liu HC, Wang K, Hsiao M, Huang CF, Shan YS, Lee AS, James Lee L. Dual targeted extracellular vesicles regulate oncogenic genes in advanced pancreatic cancer. Nat Commun. 2023 Oct 23;14(1):6692. doi: 10.1038/s41467-023-42402-3. PMID: 37872156; PMCID: PMC10593751.





