细胞外囊泡(EVs)是由细胞分泌的小型膜囊,其在细胞间运输并存在于各种生物体液中。EVs参与了从免疫调节到胚胎发育的各种生物过程。在癌症中,EVs促进了耐药性、免疫抑制、上皮-间质转化、破坏血脑屏障和器官趋向性。然而,EVs的生物分子组成高度异质,包括蛋白质、RNA、DNA、脂质和代谢产物,反映了其组织来源。尽管EVs在临床诊断中具有潜在用途,但目前用于分离和表征EVs的方法在技术上具有挑战性,部分原因是复杂生物体液中存在与EVs物理相似的颗粒,如脂蛋白(LPs)。因此,分离方法繁琐且不可重复,产生依赖于分离的囊泡特性差异。另一方面,常规的表征方法,如免疫印迹(WB)、酶联免疫吸附测定(ELISA)、定量逆转录聚合酶链反应(qRT-PCR)、下一代测序(NGS)和质谱(MS),需要囊泡裂解以获得内腔内容物。关于复杂生物体液和细胞培养基中单个EV和颗粒(siEVP)共同分离物的复杂性的新证据表明,裂解EVP会使生物体液的颗粒间复杂性变得混乱,并减弱其固有的异质性。因此,需要开发技术,以在不损害颗粒结构完整性的情况下准确高效地分析siEVP中的生物分子含量。常用于量化完整单个细胞外囊泡(siEVs)的物理和生物分子特性的分析方法包括光学和非光学技术。纳米粒子追踪分析(NTA)、可调谐电阻脉冲感测(TRPS)和微流体电阻脉冲感测(MRPS)通常用于测量siEVs的大小和浓度,其最小可检测大小在50-100纳米范围内。然而,由于表型限制,NTA、TRPS和MRPS会非特异性地整合siEVP信号。原子力显微镜(AFM)、扫描电子显微镜(SEM)和透射电子显微镜(TEM)通常用于提供siEVs的形态和机械性能,同时超越了光学的衍射极限。尽管siEVPs之间存在一些区别特征,但物理上相似的siEVPs通常难以区分,结果取决于用户。将免疫金标记与TEM相结合可以提供siEVP表面蛋白的额外表型信息,但该技术的通量低,工作强度大,且很少定量。因此,纳米流式细胞术(nFCM)可以根据侧向散射光子的强度检测到40纳米大小的siEVPs,通过结合荧光标记的抗体,可以识别siEVPs的亚群,以表面蛋白的组成为基础。然而,由于多重复用能力降低,无法检测低表达的生物标志物,由于所需浓度而导致的颗粒聚集以及广泛的校准要求,其使用受到限制。光学技术还可以应用于可调谐信号增强表面,例如等离子和干涉表面,通过免疫选择固定来检查siEVP表面蛋白的组成。此外,将随机标签序列纳入NGS的近距离条形码分析中的抗体-DNA共轭已被用于改善siEVs表面蛋白的同时分析。尽管这些有前途的技术已经展示了它们解决不同组织中siEVs亚群的能力,但siEVs的复杂内腔载体,如核酸,仍然需要相同的严谨和优化。另一方面,关于LP运输的miRNA和LP结合蛋白的生物活性的证据已经激发了用于其定量的新型工程方法。然而,目前尚未在单个LP(siLP)分辨率下进行原位生物标志物定量。近年来,超分辨显微镜技术已被应用于检测和量化亚细胞水平的荧光信号,提供了前所未有的检测极限,有助于解释siEV的异质性。直接随机光学重建显微镜(dSTORM)已被用于空间定位siEV上的蛋白质存在,并在三维中重建siEV。此外,超分辨显微镜已经发展到可以在复杂生物体液中可视化siEV,例如定量单分子定位显微镜(qSMLM),它可以检测来自血浆的siEV的蛋白质含量,以及全内反射荧光显微镜(TIRFM),它可以检测血浆和血清中siEV中的蛋白质、miRNA和mRNA,利用了脂质体融合。然而,使用脂质体会改变siEV的原始结构,并且由于与脂质体的静电相互作用,可能导致更高的背景信号。尽管所使用的固定策略可能不足以区分非EV颗粒和共同分离物,但大多数这些诊断研究忽略了类似血液来源颗粒之间的可能相互作用。因此,需要一种简便的方法,可以在不改变其原始结构的情况下,同时考虑与siLP的相互作用,从复杂生物体液中多重检测siEVP中的蛋白质和RNA。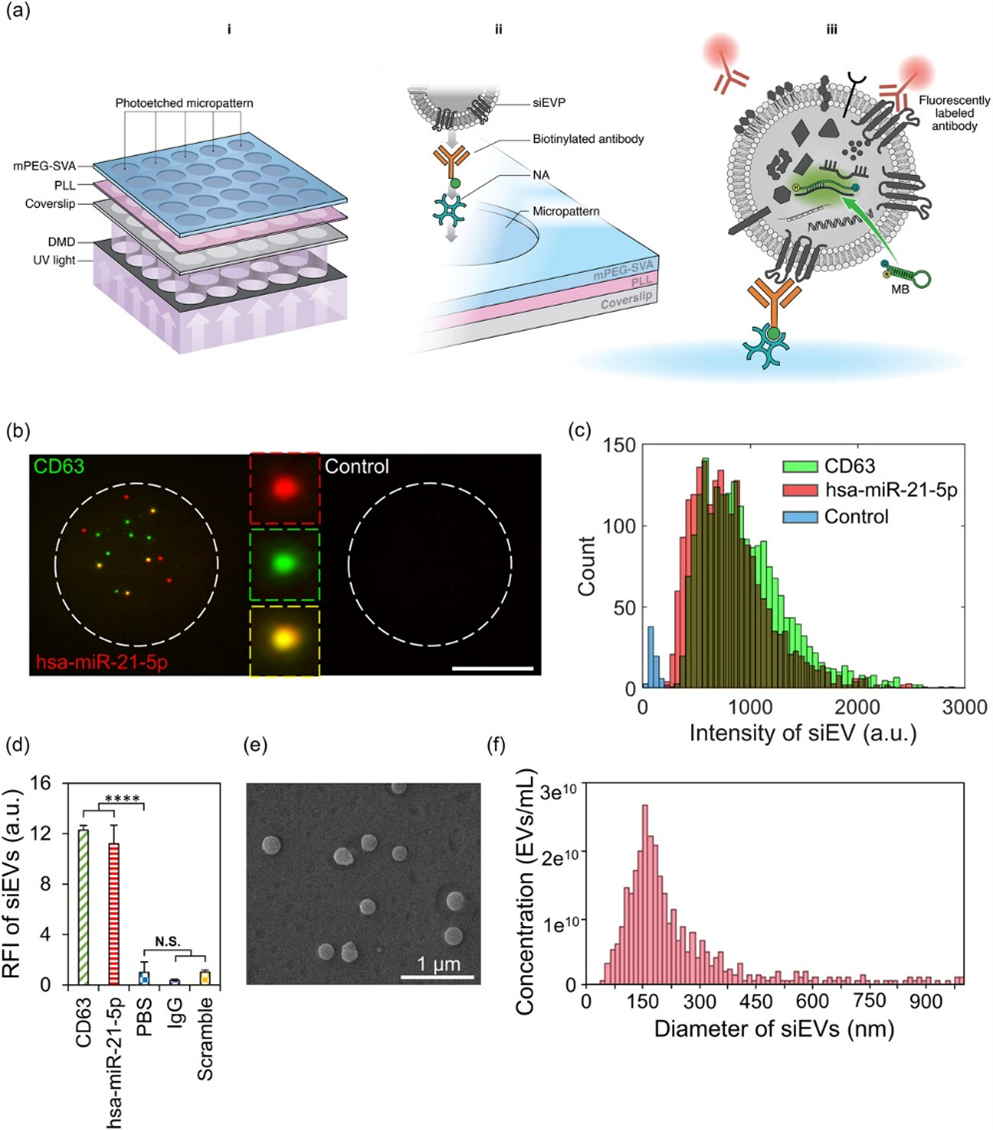
该研究描述了一种siEVP蛋白质和RNA检测方法(siEVPPRA),能够在单粒子分辨率下同时检测蛋白质和RNA生物标志物。该检测方法由一系列微图案组成,周围包裹着一层非生物污染的聚合物薄膜,可以通过功能化各种抗体来分离和固定siEVPs。这项研究以ADP-核糖基化因子6(ARF6)、A1型膜联蛋白、CD63和CD9作为EV特异性表位;以表皮生长因子受体(EGFR)作为肿瘤特异性表位;以及载脂蛋白A1(ApoA1)和载脂蛋白B(ApoB)作为LP特异性表位,以固定和定量siEVP亚群,揭示了囊泡间和颗粒间的异质性。RNA靶向分子信标(MBs)和荧光标记的抗体在siEVP上产生了mRNA、miRNA和蛋白质的信号,然后通过TIRFM进行可视化,并通过自动图像采集进行定量。通过在原位检测中集中信号,siEVPPRA的检测限度超过了qRT-PCR和ELISA三个数量级,而无需繁琐的裂解和扩增步骤。通过增强siEVP分析的灵敏度,已经发现了在siEVPPRA上通过CD63/CD9介导的捕获对CD63进行表达的单LP-EV(siLP-EV)共同分离物,这些共同分离物在大规模分析方法中被掩盖了。此外,对siEVs中不同生物分子物种的各种生物标志物进行组合多重检测,使我们能够研究siEV的囊泡内异质性。通过对从六种胶质瘤细胞系中收获的EVs进行小RNA测序(sRNA-seq)来验证复杂生物体液中完整siEVP的RNA检测,以识别与胶质母细胞瘤(GBM)相关的RNA,并扩展了siEVPPRA,以对从GBM患者的血清中分离的siEVP进行分析。这是第一个能够在不改变其原始结构的情况下同时低剂量分析siEVP上蛋白质、miRNA和mRNA的检测方法,为液体活检和生物分子发现提供了独特的应用。Zhang J, Rima XY, Wang X, Nguyen LTH, Huntoon K, Ma Y, Palacio PL, Nguyen KT, Albert K, Duong-Thi MD, Walters N, Kwak KJ, Yoon MJ, Li H, Doon-Ralls J, Hisey CL, Lee D, Wang Y, Ha J, Scherler K, Fallen S, Lee I, Palmer AF, Jiang W, Magaña SM, Wang K, Kim BYS, Lee LJ, Reátegui E. Engineering a tunable micropattern-array assay to sort single extracellular vesicles and particles to detect RNA and protein in situ. J Extracell Vesicles. 2023 Nov;12(11):e12369. doi: 10.1002/jev2.12369. PMID: 37908159; PMCID: PMC10618633.外泌体资讯网 JEV:单个细胞外囊泡和颗粒的分析方案原位检测RNA和蛋白质