在稳态和感染期间,系统性微生物组分子的细胞内监视负责着宿主生理和免疫。然而,一个长期存在的问题是循环微生物配体如何接近细胞内受体。近日,来自康涅狄格大学的研究人员在Nature Cell Biology杂志上发表文章,报道了微生物产生的游离LPS通过宿主的细胞外囊泡进入宿主细胞,激活免疫反应。
共生和致病微生物产物通常会到达循环系统,随后到达细胞内空间。系统微生物组分子模式识别受体对细胞内的监视引发了专门的反应,这些反应在塑造免疫、组织修复、代谢和脑功能方面发挥着至关重要的稳态和炎症作用。虽然这些细胞内模式识别受体及其信号传导已经相对明确,但循环微生物产物如何进入宿主细胞细胞质仍不太清楚。
一种典型的细菌产物,可以转位到细胞质中,是细菌脂多糖(LPS)。LPS的细胞质定位是有意义的,因为它引发的反应与通过TLR4引发的主要转录反应不同。细胞质LPS由非规范性炎症小体(包括人类中的caspase-4和啮齿动物中的caspase-11)感知,进而触发gasdermin D(GSDMD),导致溶解性细胞死亡(细胞焦亡(pyroptosis))和白细胞介素(IL)-1β和IL-18成熟 。在感染期间,细菌入侵细胞质和由细菌分泌的外膜囊泡使LPS定位于细胞质。然而,在许多情况下,除了与细菌或外膜囊泡结合的形式外,游离LPS也存在于循环中。补体、抗微生物肽和抗生素引起的细菌裂解将LPS从细菌中释放到循环中。肠道菌群来源的系统性LPS在人类免疫缺陷病毒、炎症性肠病、漏肠和肝病患者中经常出现。
这种无菌血液源性LPS获得细胞质定位并激活caspase-11-GSDMD介导的细胞焦亡。此外,游离LPS的细胞质转位仅在体内而非体外发生。虽然游离或纯化的LPS不能在体外培养的细胞中被动扩散穿过质膜/内体膜并成为细胞质,但在小鼠体内经全身给药后,它确实能够强有力地到达细胞质。尽管已知无菌LPS的细胞内定位及其病理生理学重要性,但循环LPS如何获得细胞质通路,触发体内独特的caspase-11激活,仍然是一个长期存在的问题。该研究发现宿主来源的细胞外囊泡(EVs)捕获系统性LPS并将其转移到细胞质,从而授权非规范性炎症小体反应,揭示了细胞质免疫监视的基本范式。
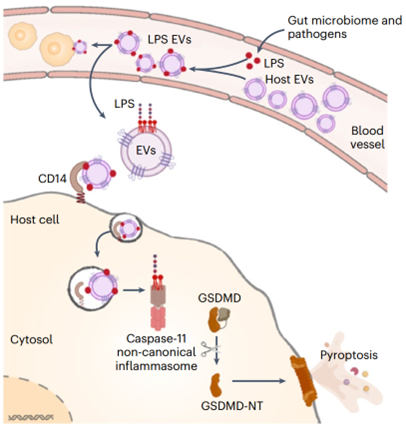
该研究展示了宿主来源的细胞外囊泡(EVs)在这个过程中的作用;人和小鼠血浆来源和细胞培养来源的EVs具有结合细菌脂多糖(LPS)的固有能力。值得注意的是,循环宿主EVs在体内捕获了血源性LPS,而LPS负载的EVs为LPS提供了细胞质通路,触发了gasdermin D的非规范性炎症小体激活和细胞焦亡。EVs的脂质双层与LPS的脂质A之间的相互作用是EVs捕获LPS的基础,EVs通过CD14介导LPS的细胞内转移。总的来说,这项研究证明了EVs捕获和护送系统性LPS到细胞质,授权炎症小体反应,揭示了EVs作为系统性微生物配体和细胞内监视之间以前未被认识的联系。
参考文献:
Kumari P, Vasudevan SO, Russo AJ, Wright SS, Fraile-Ágreda V, Krajewski D, Jellison ER, Rubio I, Bauer M, Shimoyama A, Fukase K, Zhang Y, Pachter JS, Vanaja SK, Rathinam VA. Host extracellular vesicles confer cytosolic access to systemic LPS licensing non-canonical inflammasome sensing and pyroptosis. Nat Cell Biol. 2023 Nov 16. doi: 10.1038/s41556-023-01269-8. Epub ahead of print. PMID: 37973841.





