细胞外囊泡(EVs)是释放到细胞外的膜泡结构,被认为与神经退行性疾病,包括阿尔茨海默病(AD)的发病机制有关。来自日本北海道大学的研究人员基于AD患者脑脊液EV进行了蛋白质组学分析,发现组织蛋白酶B(cathepsin B)等多个蛋白质与AD发病和进展相关联,可以成为潜在的生物标志物和治疗靶点。相关内容以“Extracellular vesicle proteome unveils cathepsin B connection to Alzheimer's disease pathogenesis”为题在线发表于12月10日的国际顶尖神经科学学术期刊Brain上。
阿尔茨海默病(AD)是全球最常见的痴呆症状的主要原因,也是一个重要的医学难题。该疾病在病理上以由β淀粉样肽(Aβ)的细胞外聚集物组成的淀粉样斑块和由磷酸化Tau蛋白(pTau)的细胞内沉积物为特征。脑脊液(CSF)中的Aβ42在AD发病前约25年开始下降,CSF中的pTau在发病前10年增加。淀粉样级联假说表明Aβ沉积触发了一系列随后的神经毒性(由于pTau)和神经炎症(由于活化的小胶质细胞)。AD进展的病理分类在每个临床阶段被称为Braak分期;CSF中Aβ42和pTau的水平反映了疾病的组织病理特征和Braak分期。近年来,外泌体(EVs)介导的病原蛋白在神经元之间的传播被认为参与了AD的进展。
诸如细胞外囊泡(EVs)之类的膜泡,例如外泌体(50–150 nm)、微囊泡(150–1000 nm)和凋亡小体(1000–5000 nm),是含有多种蛋白质、脂质和核酸的分泌性膜囊泡。它们的性质和载荷的数量取决于细胞类型,通常也取决于供体细胞的病理状态。EVs来自各种细胞,包括中枢神经系统中的细胞,报道称来自中枢神经系统的EVs含有诸如Aβ、其降解酶和Tau等分子,这些分子在AD的病因中起着重要作用。此前,研究团队曾报道了神经元来源的EVs能够捕获并将Aβ传递给小胶质细胞进行降解。此外,发现抑制EVs的产生可减少AD小鼠模型中的Aβ淀粉样沉积。此外,EVs可以介导病原性Tau种类的神经元间传播。由于EVs可以从各种体液中收集,包括血液、尿液和脑脊液,它们携带的分子可以被视为循环的媒介,从而以微创方式(即基于血液)获取有关供体细胞的分子信息,能够对疾病状态进行长期连续监测。
近年来,随着疾病修饰药物的发展,对早期诊断AD的趋势逐渐增加。2011年,美国国家老龄化研究所和阿尔茨海默病协会(NIA-AA)将整个AD过程分为:(i)临床前期;(ii)由于AD引起的轻度认知障碍(MCI);和(iii)AD痴呆。如果CSF中Aβ42水平下降,就可以对AD进行临床前期诊断判定。2018年,NIA-AA制定了根据Aβ沉积(A)、病理性Tau(T)和神经退行性过程(N)的ATN生物标志物对AD病理过程进行分类的指南,将临床诊断转变为生化诊断。ATN分类最初是为研究目的而制定的;但逐渐被应用于临床医学。该系统最终实现了基于生物标志物的早期(临床前期)诊断。
在这项研究中,研究人员利用ATN分类的样本,针对EVs进行了研究,探索了新的致病因素和生物标志物。研究人员采集和储存了CSF和血浆样本,采用统一的收集程序和生物库存协议,并进行了ATN分类。研究人员排除了显示非AD病理性改变的群体,而选择了具有正常AD生物标志物和处于AD连续性上的患者。然后,根据ATN分类对CSF EVs进行蛋白质组学分析,以确定与疾病病理进展一致的水平变化的独特蛋白质。
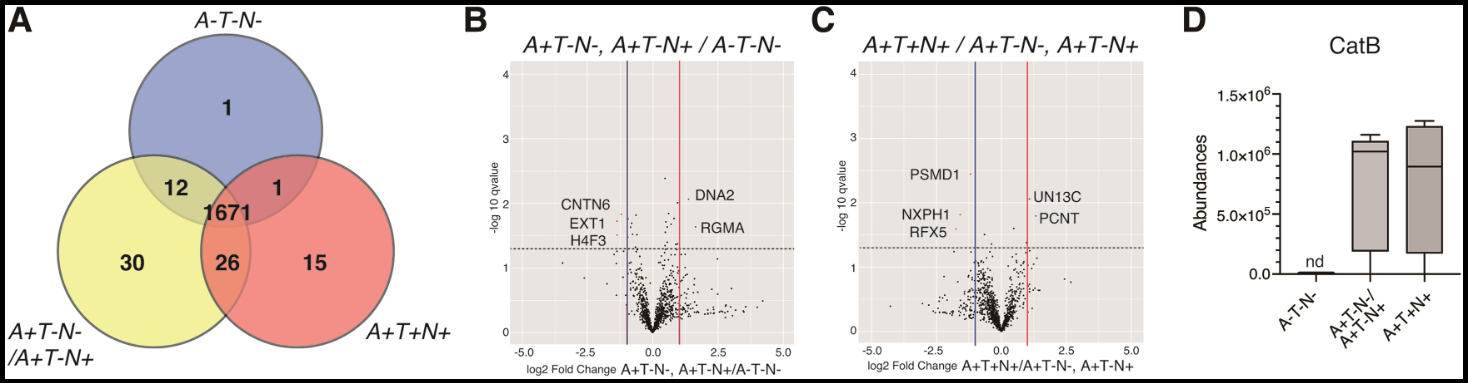
在16个ATN分级病例的CSF EVs的定量蛋白质组分析结果中,有11种蛋白质的水平在ATN阶段转换期间显著改变(P < 0.05,差异倍数 > 2.0)。这些蛋白质被认为与阿尔茨海默病的发病机制有关,并且代表了病理阶段分类的候选生物标志物。对CSF和血浆EVs的酶联免疫吸附测定分析显示,在ATN转换期间(验证集中的七个ATN组,n = 136),脑脊液和血浆EVs的组织蛋白酶B(cathepsin B,CatB)水平发生了改变。脑脊液和血浆EVs中的CatB水平与脑脊液中Aβ42的浓度呈负相关。因此,在ATN分类中,CSF EVs的这种蛋白质组学景观可以描绘阿尔茨海默病进展的分子框架,而CatB可能被视为阿尔茨海默病淀粉样病理的有希望的候选生物标志物和治疗靶点。
参考文献:Extracellular vesicle proteome unveils cathepsin B connection to Alzheimer's disease pathogenesis. Brain 2023. Doi:10.1093/brain/awad361.