RNA结合蛋白(RBPs)是一类能够与RNA结合的蛋白质,通过与RNA结合调控RNA的空间结构和转录后翻译等过程,从而进一步影响RNA在细胞中的相关功能。近年来,人们发现RBPs在肿瘤的发生发展中发挥着关键作用。有趣的是,RBPs还能调控非编码RNA(ncRNA)装载到外泌体(Exosomes)中,这意味着RBPs具有调控Exosomes功能的作用,阐述RBPs如何影响肿瘤的进展具体制可以有利于发现新的抗肿瘤治疗靶点。近日,上海中医药大学的张辉课题组在Journal of Advanced Research上发表了题为“Exploring the roles and molecular mechanisms of RNA binding proteins in the sorting of noncoding RNAs into exosomes during tumor progression”的综述(2023 Nov 27:S2090-1232(23)00368-5)。这篇综述系统地阐述了Exosomes的形成过程和机制,并讨论了RBPs、ncRNA和Exosomes之间的相互关系。综述总结了RBP-ncRNA-exosome机制是如何通过促进转移、药物耐药、血管新生和建立免疫抑制性微环境来促进肿瘤的进展的。基于RBP-ncRNA-exosome机制,提出开发新药物来针对RBPs,或者通过基因工程研发治疗性Exosomes等潜在治疗手段,有助于推动抗肿瘤治疗的发展。
首先,作者介绍了Exosomes的形成过程。Exosomes的形成始于细胞质膜的内陷,形成初级内体(early endosome)。随后,多种机制被启动以促进腔内囊泡(intraluminal vesicles, ILV)的形成。随着早期内体的进一步酸化成熟,形成次级内体(late endosome)。最后,晚期内体与质膜融合,释放其中的ILV,这些释放出来的ILV被称为Exosomes。综述进一步介绍了ILV的生成机制。主要有四个途径:the ESCRT-dependent pathway(ESCRT依赖途径)、the Alix-dependent pathway(Alix依赖途径)、HD-PTP-dependent pathway(HD-PTP依赖途径)和the independent ESCRT pathway(独立ESCRT途径)。这些途径的介绍展示了参与Exosomes形成过程的蛋白质,这对于我们理解RBPs如何促使ncRNA进入Exosomes具有重要意义。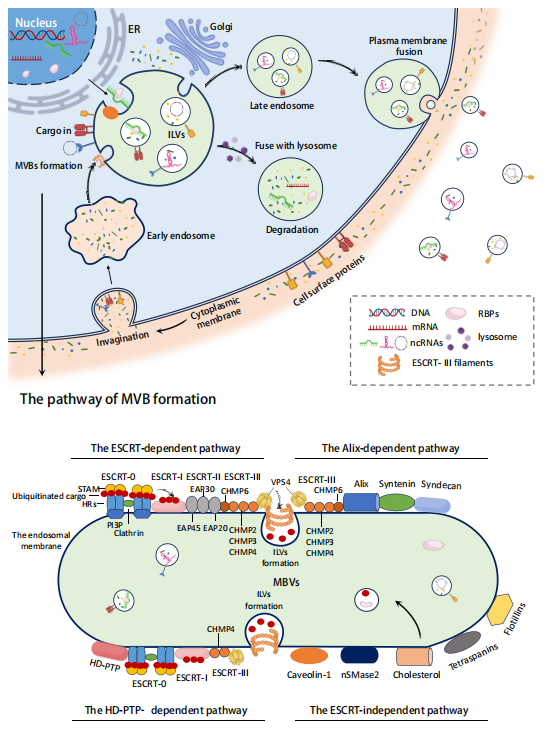
随后,作者详细阐述了RBPs、ncRNA和Exosomes之间的关系,并发现RBPs在调控Exosomes中的ncRNA扮演着关键的角色。RBPs能够直接与ncRNA上的特定序列结合形成RBPs-ncRNA复合物。此外,Exosomes膜上的膜蛋白,如Caveolin-1、IC3、nSMase2、ESCRT复合物,能与RBPs相互作用。在此过程中,部分RBPs-ncRNA复合物可以直接装载到Exosomes中,或者RBPs被泛素化从而导致复合物解离,使ncRNA被直接装载到Exosomes内。然而,尚不清楚RBPs如何特异性结合ncRNA并帮助其装载到Exosomes中的详细机制。当装载了ncRNA的Exosomes进入目标细胞后,它们可以通过调控RBPs来激活下游信号通路,从而影响目标细胞的功能。
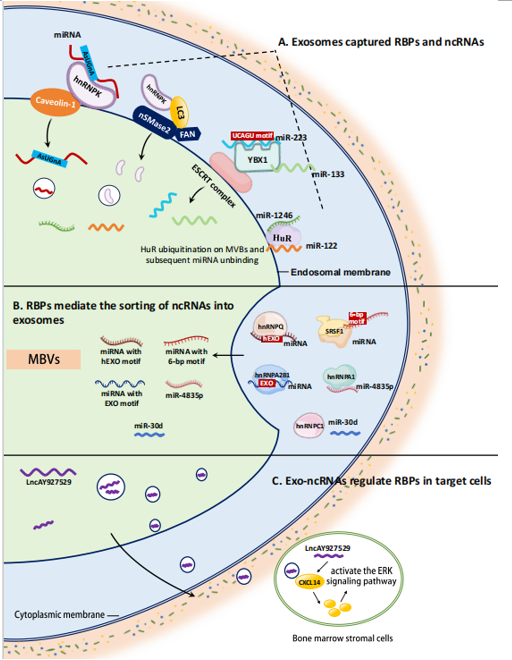
图2 RBPs、ncRNA和Exosome之间的关系接下来,作者对RBP-ncRNA-exosome机制在肿瘤的发生和发展中的关键作用进行了总结。在肿瘤细胞中,许多RBPs的表达水平显著增加,并且它们能够通过特定基序的结合与ncRNA相互作用,将其选择性地装载到Exosomes中。这也解释了不同细胞来源的Exosomes中ncRNA差异巨大的原因。进一步地,这些带有ncRNA的Exosomes通过运输作用进入其他靶细胞中,激活多种信号通路,从而促进肿瘤的进展。例如,通过激活PROX1和VEGF3信号通路,Exosomes中的exo-ncRNA可以促进淋巴结转移,降低血管通透性,进而促进肿瘤细胞的转移。这些机制的了解有助于我们深入理解肿瘤的发展过程,为未来开发针对RBPs或基因工程的治疗策略提供了新的方向。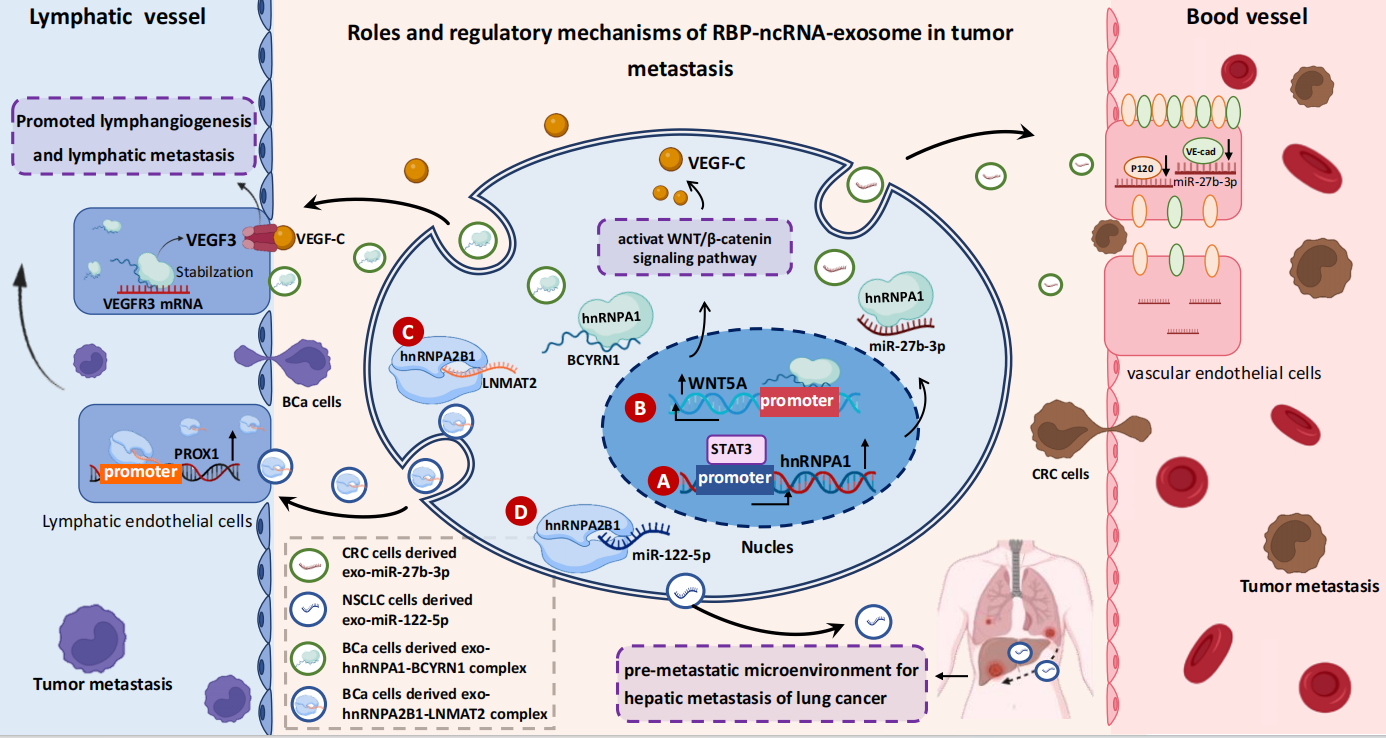
图3 RBP-ncRNA-exosome机制促进肿瘤转移该机制还可以通过上调或下调耐药基因的表达,抑制铁死亡来促进肿瘤耐药。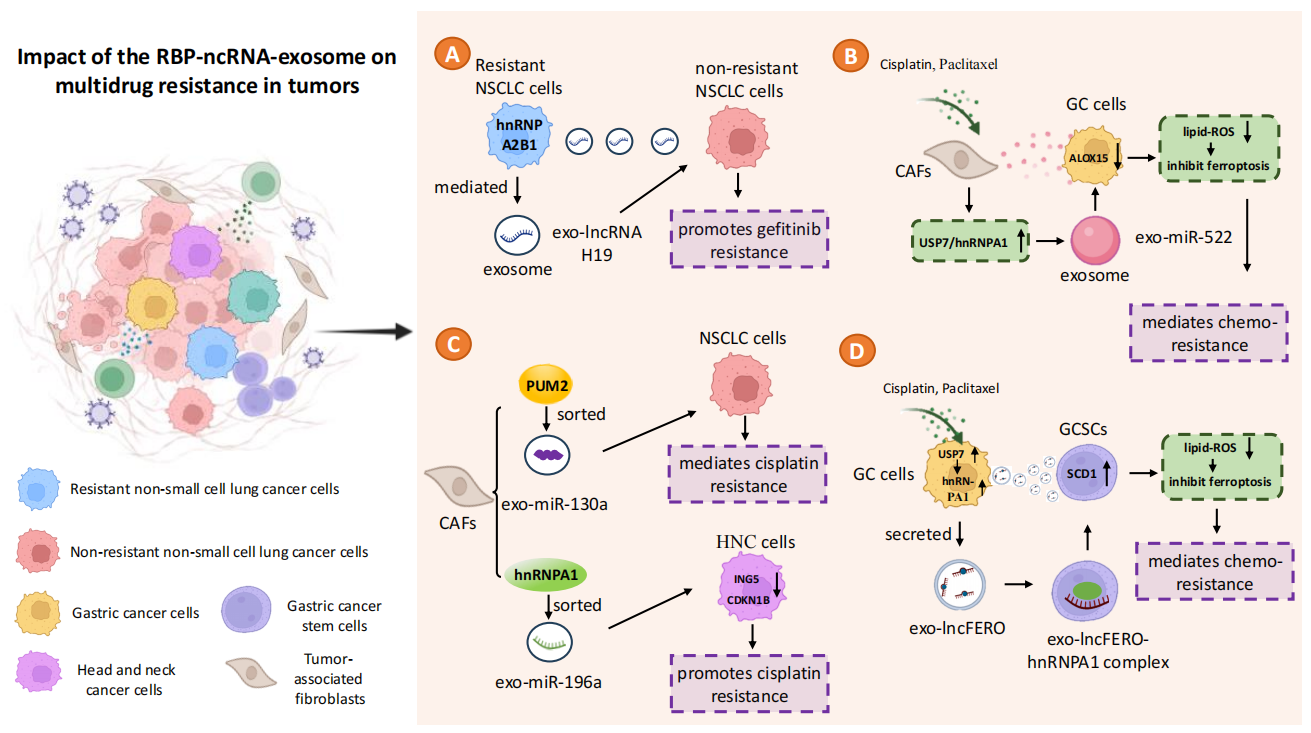
图4 RBP-ncRNA-exosome机制促进肿瘤耐药 RBP-ncRNA-exosome机制同样可以建立免疫抑制性微环境来帮助肿瘤细胞逃逸免疫监测。例如,在脑胶质瘤中,hnRNPA1促进miR-1246选择性地装载到Exosomes中,并通过exo-miR-1246将单核细胞极化为髓系抑制性细胞(MDSCs),从而抑制CD8+T细胞的增殖。hnRNPA2B1则促进exo-circNEIL3的分泌,将巨噬细胞极化为肿瘤关联巨噬细胞(TAMs),形成免疫抑制性微环境。这些发现提示RBP-ncRNA-exosome机制对于调控肿瘤免疫逃逸及免疫抑制性微环境的形成发挥着关键作用。这些机制为进一步了解肿瘤免疫逃逸的分子机制提供了新的线索,为肿瘤治疗策略的发展提供了方向。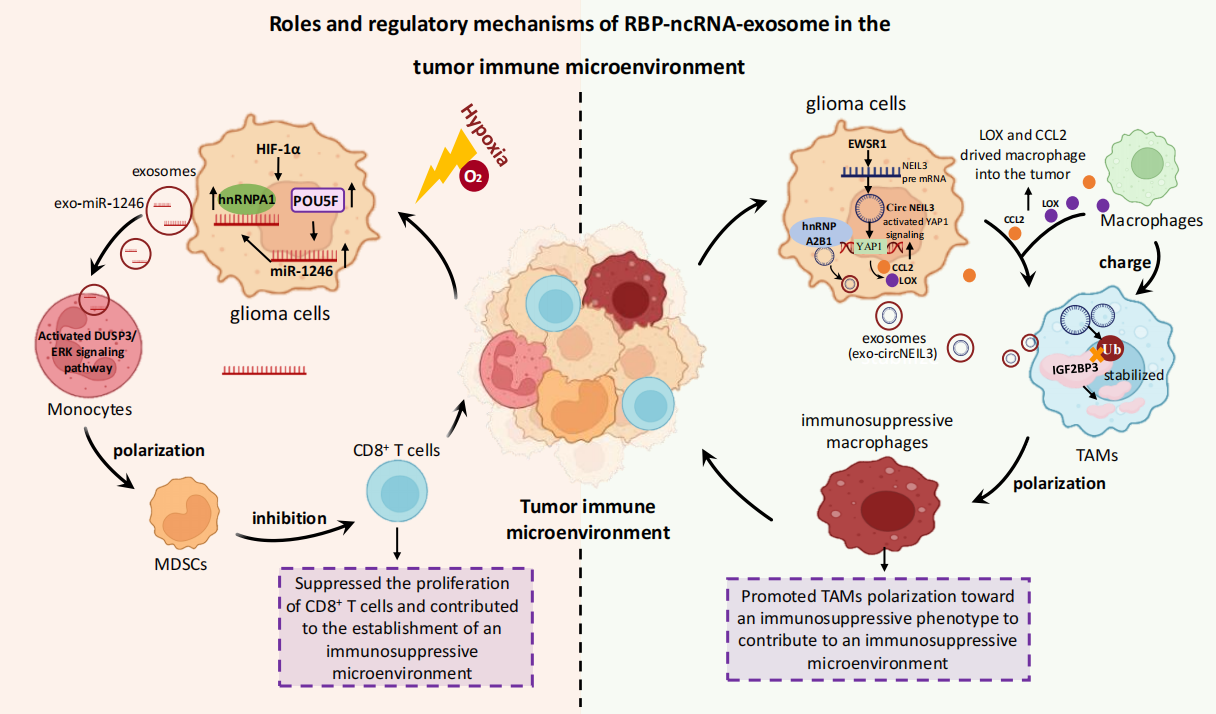
图5 RBP-ncRNA-exosome机制帮助建立免疫抑制性微环境另外, RBP-ncRNA-exosome机制还能激活VEGF信号通路,抑制CXCL10信号通路来促进血管新生,导致肿瘤的进展。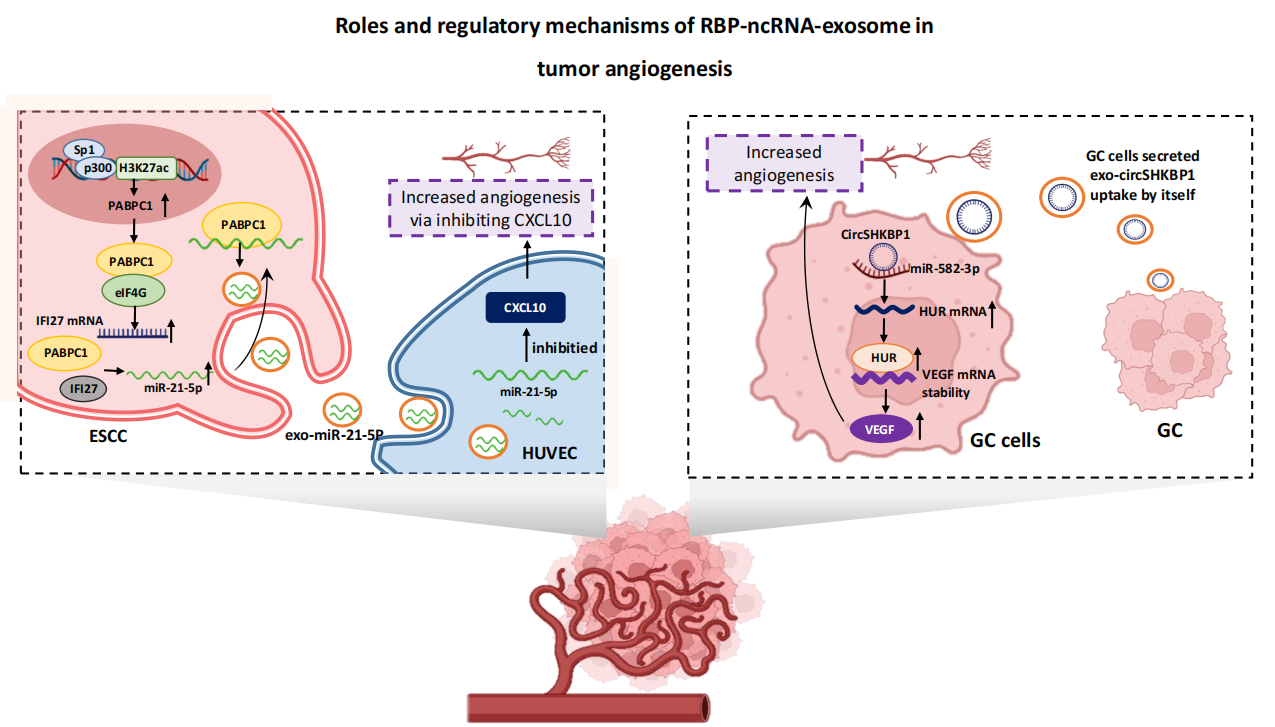
图6 RBP-ncRNA-exosome机制促进肿瘤血管新生通过总结细胞间的RBP-ncRNA-exosome机制,展示了细胞之间信息传递和肿瘤发展的复杂机制,为肿瘤治疗提供了新的思考方向。在这些机制的基础上,作者提出可以从以下两点入手:首先,可以通过靶向RBPs的策略开发新的药物。目前已经证实一些小分子化合物可以抑制RBPs的表达和活性,削弱RBPs在细胞核和细胞质之间的转运能力,竞争性结合RBPs,或直接破坏RBPs与mRNA的结合能力,从而阻断RBPs与mRNA的结合。这些化合物最终抑制了下游促癌信号通路,产生抗肿瘤效果。因此,靶向RBPs可能是一种潜在的抗肿瘤疗法。其次,可以通过靶向Exosomes来进行治疗。Exosomes的主要功能是其运输作用和靶向作用,其调控靶细胞的能力主要来自于Exosomes中的ncRNA。如前所述,exo-ncRNA可在疾病进展和疾病治疗中发挥双重作用。因此,必须从两个角度来考虑exo-ncRNA:i) 阻碍肿瘤进展的exo-ncRNA 可促进其分泌或大量人工合成;目前仅有少数天然化合物及热疗方法具有促进Exosomes分泌的作用,该领域研究较少,因此有必要进一步探索更多的药物或技术手段来提高抗肿瘤的exo-ncRNA的分泌。比如人工合成治疗性exo-ncRNA。可以通过基因工程将特殊的结合基序添加到具有抗肿瘤作用的ncRNA上,并且将RBPs与Exosomes膜蛋白融合,来增加这类ncRNA对Exosomes的亲和力,帮助这类ncRNA装载到Exosomes中。再提高Exosomes对肿瘤细胞的靶向性,比如对Exosomes膜上添加能靶向受体细胞的多肽,使exo-ncRNA有选择性的靶向到肿瘤细胞中,发挥抗肿瘤作用。同时,作者也发现治疗性Exosomes的研发和应用仍然有很多困难,比如Exosomes的产量、质控、靶向性和装载效率等问题依然存在,需要技术解决方案。但这一方向依然具有极大潜力,毕竟在给药系统中,Exosomes的安全性、稳定性、时效性具有绝对优势,深入的研究和探索使治疗性Exosomes转化到临床中,是一项极具挑战但充满希望的工作。ii) 促进肿瘤进展的exo-ncRNA 可抑制其产生。抑制exo-ncRNA 的产生过程是一种有潜力的治疗方法。目前已开发出许多抑制Exosomes产生的化合物,其主要作用机制是靶向参与Exosomes生成的蛋白质。例如,tipifarnib靶向RAB27a、Alix和nSMase2,GW4869靶向nSMase2,质子泵抑制剂(PPI)靶向V-ATP酶等等。同时,一些天然药物也能抑制Exosomes的释放,比如大麻二酚。总之,作者认为治疗性Exosomes抗肿瘤是一把双刃剑,一方面可以促进癌症的进展,另一方面也可以抑制癌症的进程。对于研究人员来说,在开发个性化治疗方案之前,有必要首先了解exo-ncRNA的特定功能。不同肿瘤细胞来源的Exosomes差异很大,这意味着将Exosomes应用于各种临床治疗面临巨大挑战。不过,我们相信,利用基因工程人工合成针对不同患者的个性化治疗性Exosomes具有很好的应用前景。上海中医药大学交叉科学研究院张辉研究员为该论文的通讯作者,王婷为论文的第一作者。Exploring the roles and molecular mechanisms of RNA binding proteins in the sorting of noncoding RNAs into exosomes during tumor progression. J Adv Res. 2023 Nov 27:S2090-1232(23)00368-5. doi: 10.1016/j.jare.2023.11.029.原文链接:https://doi.org/10.1016/j.jare.2023.11.029外泌体资讯网 <综述> J Adv Res | 上海中医药大学张辉:肿瘤进展过程中RNA结合蛋白在非编码RNA分选到外泌体中的作用和分子机制











