重症肢体缺血是外周动脉疾病晚期形式,截肢率和死亡率风险高,然而临床尚缺乏有效治疗药物。干细胞疗法具有组织修复再生功能,有望成为治疗重症肢体缺血疾病的突破口,并已被纳入国家战略性发展规划。影响干细胞药物上市的原因主要在于潜在的致癌风险,和病理环境下干细胞功能受损。多量研究表明,干细胞主要通过旁分泌途径发挥修复作用,其中干细胞分泌的细胞外囊泡在修复过程中尤为重要。细胞外囊泡为细胞膜上脱落或者分泌的具有膜结构的囊泡状小体,干细胞通过胞吐囊泡打包其分泌的生长因子进行高效旁分泌输出。因此,细胞分泌无生命活性的囊泡通过继承母细胞功能,有望解决干细胞在缺血微环境中功能活性不稳定、修复效率被削弱的临床应用瓶颈。近期,中山大学冯敏教授课题组与海南大学郭羚教授合作在Nature Communications发表题为“Enhanced pericyte-endothelial interactions through NO-boosted extracellular vesicles drive revascularization in a mouse model of ischemic injury”的研究论文(2023 Nov 13;14(1):7334)。该研究将NO纳米笼修饰至间充质干细胞来源的纳米囊泡表面,用以构建一氧化氮(NO)增强型干细胞囊泡(nitric oxide-boosted and activated nanovesicle regeneration kit,n-BANK)。该研究结果表明,n-BANKs可通过拯救血管内皮细胞活力、激活eNOS功能及其磷酸化过程,实现缺血部位NO的长效稳定释放,继而招募周细胞与之形成成熟血管,重塑缺血下肢血运。
新生血管主要由血管内皮细胞和周细胞组成。血运重建过程涉及血管内皮细胞的增殖和迁移,以及周细胞的募集。然缺血组织中血管内皮细胞活力受损,内源性NO合成功能降低,进而周细胞流失、血液供应障碍。基于此,为实现血管内皮细胞的精准调控与周细胞的长效招募,作者将携带NO的白蛋白纳米笼修饰至嵌合磷脂酰胆碱的干细胞纳米囊泡表面,利用白蛋白与血管内皮细胞高表达的GP60受体亲和力,介导n-BANK靶向进入缺血部位中血管内皮细胞。并在n-BANK内含的VEGFα等生长因子作用下,拯救受损血管内皮细胞,进而调节胞内eNOS/p-eNOS表达量,诱导内源性NO产生,营造富NO组织微环境。受NO信号刺激,周细胞响应性迁移,移动至血管内皮细胞附近。在n-BANK作用下,血管内皮细胞与被招募至其周围的周细胞相互作用,有效稳定了血管样结构,促使新生血管成熟功能化。经体内外实验证实,n-BANK治疗组显著促进了血管新生,提高缺血部位血液浸润量,有效重塑了下肢血运,使其恢复至与对侧健康下肢同等的血流情况和运动功能。且剂量降低至1/10时,仍具有显著优于其他对照组的治疗效果。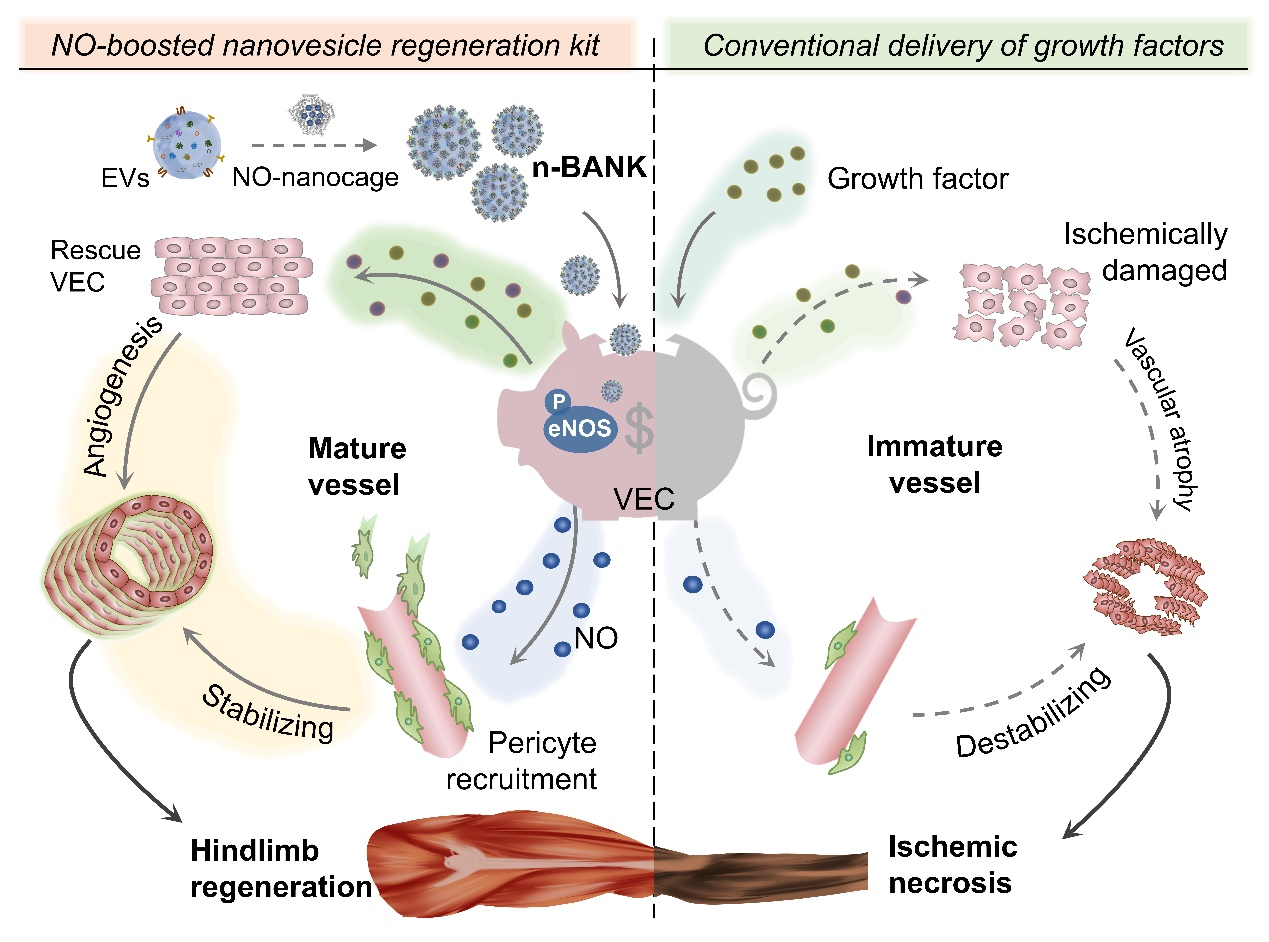
综上,立足于修复再生是我国人口与健康领域的重大需求,为突破干细胞疗法的致癌隐患及病理环境功效不足的应用瓶颈,该研究构建了NO增强型干细胞纳米囊泡(n-BANK),利用NO信号分子驱动血管内皮细胞与周细胞之间的信息交流,并在体内外实验证实其可高效招募周细胞至缺血病灶,并与血管内皮细胞形成新生血管。文章研究成果表明,n-BANK激活eNOS/NO信号轴驱动血管内皮细胞-周细胞交互作用,促进新生血管从“成形”进阶“功能化”,为突破干细胞应用瓶颈和解决下肢缺血疾病高截肢率临床难题提供制剂新设计和治疗新策略。Enhanced pericyte-endothelial interactions through NO-boosted extracellular vesicles drive revascularization in a mouse model of ischemic injury. Nat Commun 14, 7334 (2023). https://doi.org/10.1038/s41467-023-43153-x外泌体资讯网 Nat Commun | 冯敏/郭羚科研团队:NO增强型干细胞纳米囊泡驱动细胞对话增效血运重塑