人体真菌病原体白色念珠菌引起的炎症的主要标志是宿主类型I干扰素(IFN)途径。然而,激活这种途径以对抗白色念珠菌的宿主防御的分子机制仍然未知。近日,哈佛大学的研究人员在Nat Microbiol杂志上发表文章,报道了白色念珠菌细胞外囊泡通过cGAS和STING触发I型IFN信号传导。
白色念珠菌(Candida albicans)血液感染是现代医学的可怕并发症,死亡率超过50%。由于该病原体的真核性质,再加上对白色念珠菌如何与宿主免疫系统进行通信的机制缺乏理解,因此治疗这种致命感染受到限制。人类外周血单核细胞(PBMCs)中的转录组分析确定了白色念珠菌感染后I型干扰素(IFN)特征。除了血流感染外,黏膜感染模型还展示了使用多种Candida物种的动态IFN响应。已知的IFN刺激基因(ISG),MDA5和IFN受体IFNAR参与白色念珠菌的免疫反应。白色念珠菌触发强大且似乎具有抗病毒特性的IFN反应的概念是新颖的,激活机制包括涉及的真菌配体的全部组成部分,尚未被发现。IFN基因的刺激剂(STING)途径是已知的主要IFN产生途径,用于响应微生物病原体。最近,已经证明STING在白色念珠菌挑战性树突状细胞中结合Src以抑制Syk介导的信号传导。STING途径的激活也可以在细胞质中的双链DNA被cyclic GMP-AMP合成酶(cGAS)感知时发生,从而触发信号级联,激活IFN调节因子3(IRF3)转录因子以转录早期ISG和IFN(IFNβ和IFNα)。
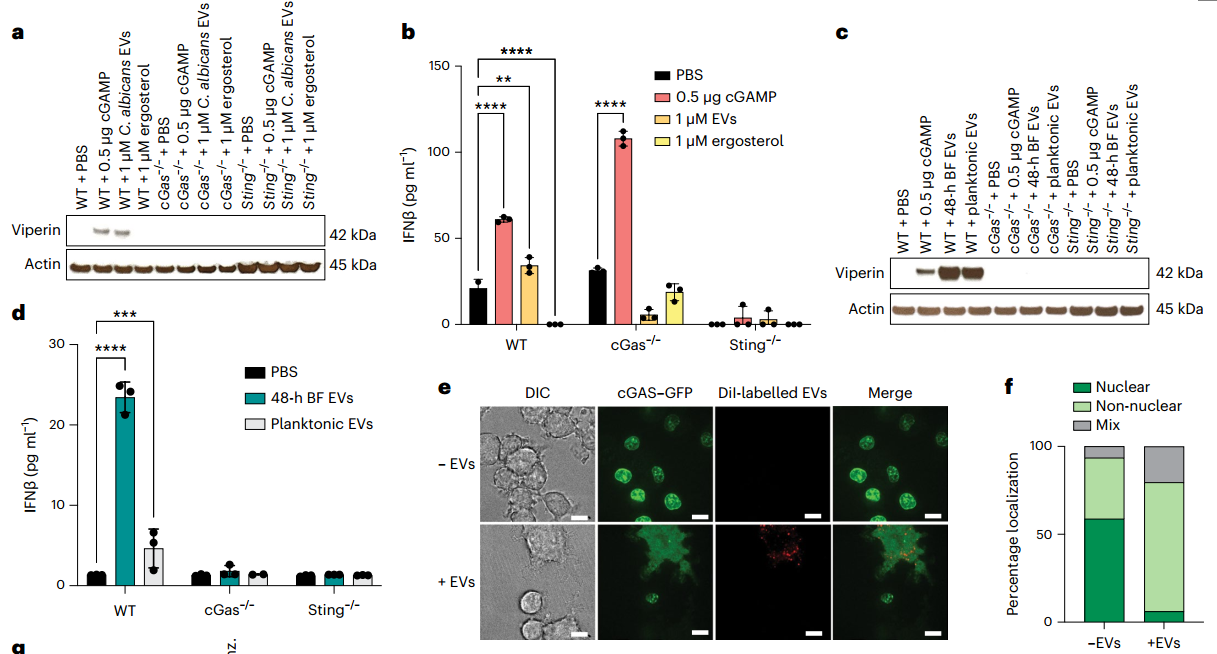
白色念珠菌和其他致病真菌分泌细胞外囊泡(EVs),其中包含效应分子,毒力因子,表面蛋白和核酸,以传递信息并促进真菌细胞之间的交流。白色念珠菌EVs作为STING途径的刺激剂是强有力的候选者,因为它们包含核酸,引发促炎免疫反应,是生物膜(BFs)和真菌团块的主要成分,并且可以被免疫细胞内化。已知从肠道微生物群分泌的含有DNA的EVs会激活类型I IFN并触发外周cGAS-STING。该研究假设白色念珠菌EVs包含触发巨噬细胞细胞质中cGAS和STING依赖的类型I IFN信号的配体,而宿主细胞,如巨噬细胞,劫持真菌EVs以重构和为即将到来的病原体挑战做好准备。
该研究揭示了巨噬细胞和白色念珠菌之间STING固有免疫信号通路之间的强烈联系。这些数据共同揭示了一种宿主细胞重新编程的模型,该模型在固有免疫细胞遇到白色念珠菌EVs之前发生。这些发现是首次提出真菌病原体通过cGAS-STING途径激活巨噬细胞的机制,并确定了EV在为即将到来的感染做好宿主细胞的准备方面的作用。
该研究发现,缺乏环磷酸鸟苷酸-腺苷酸合成酶(cGAS)-干扰素基因刺激剂(STING)途径组分的小鼠在静脉注射白色念珠菌后生存率有所提高。生物膜相关的白色念珠菌DNA包装在细胞外囊泡中,通过诱导干扰素刺激基因、IFNβ产生以及干扰素调节因子3和TANK结合激酶1的磷酸化来触发cGAS-STING途径。细胞外囊泡诱导的I型IFN的激活与Dectin-1/Card9途径无关,也不需要Toll样受体9。cGAS和STING的单核苷酸多态性在人单核细胞受到白色念珠菌挑战时强烈改变了炎性细胞因子的产生。这些研究为临床意义重大的真菌病原体引起的早期先天免疫反应提供了见解。