三阴性乳腺癌由于缺乏内分泌和靶向受体,具有高异质性,高复发转移率,总生存期短等特点,目前化疗仍是其主要的临床治疗方案。近年来植物活性核酸包括miRNAs被证明能够跨界调控哺乳动物细胞的靶基因表达,可作为一种有效的信号分子发挥显著的药理活性和疾病治疗作用。近日,浙江大学药学院彭丽华团队首次分离了中药鸦胆子衍生的外泌体样纳米囊泡(B. javanicafruits-derived exosomes, BF-Exos),发现其可作为一种高效的活性miRNA递送纳米平台发挥抑制乳腺癌生长、转移和血管生成的疗效,具有开发成为新型三阴性乳腺癌生物治疗药物的巨大潜力。该研究成果以“Brucea javanica derived exosome-like nanovesicles deliver miRNAs for cancer therapy”为题,发表在Journal of Controlled Release上(2024, 367: 425-440)。
这项研究中,作者成功提取纯化了中药鸦胆子来源的植物外泌体囊泡并阐明了其在4T1乳腺癌模型中的影响和潜在的分子机制。研究发现BF-Exos能向4T1细胞递送10种功能性miRNAs,通过调节PI3K/Akt/mTOR信号通路和促进ROS/Capase介导的细胞凋亡,显著延缓4T1细胞的生长和转移。此外,BF-Exos被证明可以抑制血管内皮生长因子的分泌,调节血管内皮细胞的生物学功能,有助于抗肿瘤微环境中的血管生成。基于以上干预机制,BF-Exos能够显著抑制4T1荷瘤小鼠的肿瘤生长、转移和血管生成,且具有高度生物安全性。BF-Exos被证明是一种新型的药用植物核酸纳米递送平台,在治疗三阴性乳腺癌中发挥协同抑制血管生成和肿瘤发展的双重作用。这项研究旨在充分挖掘药用植物新功效成分价值并阐明其作用机理,拓宽植物外泌体囊泡研究领域,并为开发药用植物纳米新制剂与安全有效的三阴性乳腺癌治疗策略提供参考。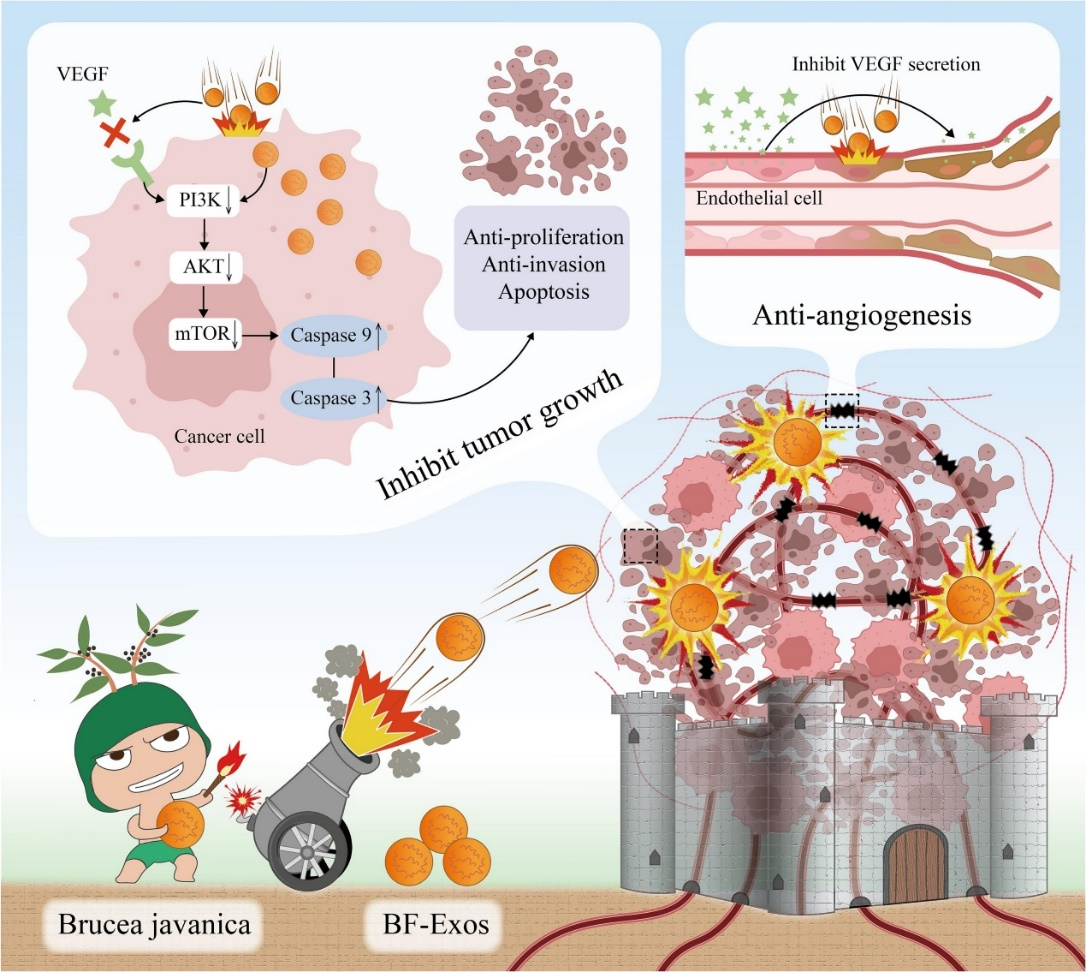
示意图. BF-Exos抑制TNBC肿瘤生长和血管生成的分子机制Brucea javanica derived exosome-like nanovesicles deliver miRNAs for cancer therapy, J Control Release. 2024 Feb 2:367:425-440.外泌体资讯网 J Control Release丨浙江大学药学院彭丽华团队:中药鸦胆子衍生的外泌体样纳米囊泡递送miRNAs用于癌症治疗