来源于间质干细胞的细胞外囊泡(EVs)由于其再生和免疫调节特性,在肝脏疾病的纳米治疗中具有很大的潜力。然而,人们对外源性EVs被吞噬细胞快速清除的担忧引起了关注。来自英国伦敦国王学院的研究人员发现,不同的培养方法会影响EVs表面的蛋白冠组成,以及随后对肝细胞的靶向和积聚。相关研究以“Cellular uptake and in vivo distribution of mesenchymal-stem-cell-derived extracellular vesicles are protein corona dependent”为题在线发表于2月16日的国际顶级纳米科学期刊Nature Biotechnology杂志上。
尽管慢性肝病可以由各种不同的病因引起,但它们都具有持续的炎症、氧化应激和瘢痕形成的特征,这些因素共同促进了肝脏的恶化、肝硬化,最终导致肝功能衰竭和死亡。这种病理生理过程的发展涉及多种不同类型的肝细胞亚群,包括肝细胞、肝星状细胞、肝窦内皮细胞(LSECs)、巨噬细胞和淋巴细胞。因此,要开发一种广谱治疗方法,能够改善多种肝病,就需要有针对不同肝细胞群的潜在治疗途径。
越来越多的证据表明,间充质干细胞(MSCs)的免疫调节和再生属性是通过它们分泌的细胞外囊泡(EVs)的旁分泌效应介导的。在肝损伤的临床模型中,研究表明MSC来源的EVs(MSC EVs)可以减少胶原沉积和肝脏炎症,抑制肝星状细胞的活化,促进肝细胞增殖,并抑制肝细胞凋亡。与基于细胞的方法相比,利用EVs作为治疗剂带来许多额外的好处,包括易于大规模生产、便于存储和批次质量控制。与基于细胞的方法不同,EVs也可以通过表面修饰等方式进行工程化,以改善药代动力学和药效动力学特性。
此前的研究显示,来自癌细胞和非癌细胞的EVs经静脉注射后可以在肝脏中积聚,尽管它们的细胞摄取特征尚不清楚。最近的研究表明,所谓的“蛋白冠(protein corona)”会显著影响体内合成颗粒的行为,包括细胞靶向。然而,蛋白冠对EVs在体内命运的影响尚未被揭示。
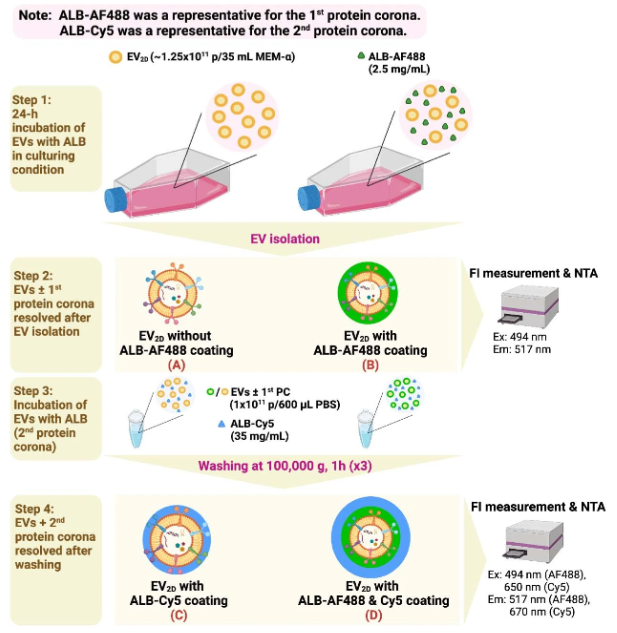
蛋白冠是指纳米粒子(NPs)与生物体液接触时形成的现象,蛋白质会吸附到NP表面。与合成NPs不同,培养来源的EVs在两个时间点与蛋白质接触:首先是在细胞培养条件下的EVs生产过程中,然后是在EVs被注射使用时。因此,它们的包被冠可能由“初级”和“次级”两部分组成,分别形成于生产地点和与体液接触时。这两种包被冠对颗粒特性和体内行为的相对贡献尚待描述。
在这项研究里,研究人员探讨了来自两种培养条件的EVs的蛋白冠的影响,发现这两种条件中从培养基中获得的特定蛋白质同时被吸附在EV表面。此外,通过将EVs与血清孵育,模拟了在系统输送过程中蛋白冠的形成,进一步研究了蛋白冠-EV复合物的模式。研究发现揭示了蛋白冠成分对体外条件下EVs及其体内动力学的潜在影响。通过二维(EV2D)和三维(EV3D)培养中分离出MSC EVs,并进行了比较蛋白质组学分析,并测量了EVs在肝脏细胞亚群中的生物分布和摄取。使用主成分分析(PCA)来将蛋白冠组成与生物功能相关联。数据表明,结合白蛋白产生的一种EV标记,可以避免被肝脏巨噬细胞吞噬,EVs的定向方式被重新调节。这导致肝细胞、肝窦内皮细胞和肝星状细胞的细胞摄取显着改善。这种现象可以作为一种伪装策略,通过预先包被白蛋白来制备富含白蛋白的蛋白冠-EV复合物,增强在肝脏的非吞噬性摄取。这项工作通过为肝细胞定向和免疫逃避量身定制蛋白冠-EV复合物,解决了静脉注射EVs治疗肝脏疾病面临的一些关键挑战。
参考文献:Cellular uptake and in vivo distribution of mesenchymal-stem-cell-derived extracellular vesicles are protein corona dependent. Nat Nanotechnol. 2024 Feb 16. doi: 10.1038/s41565-023-01585-y.