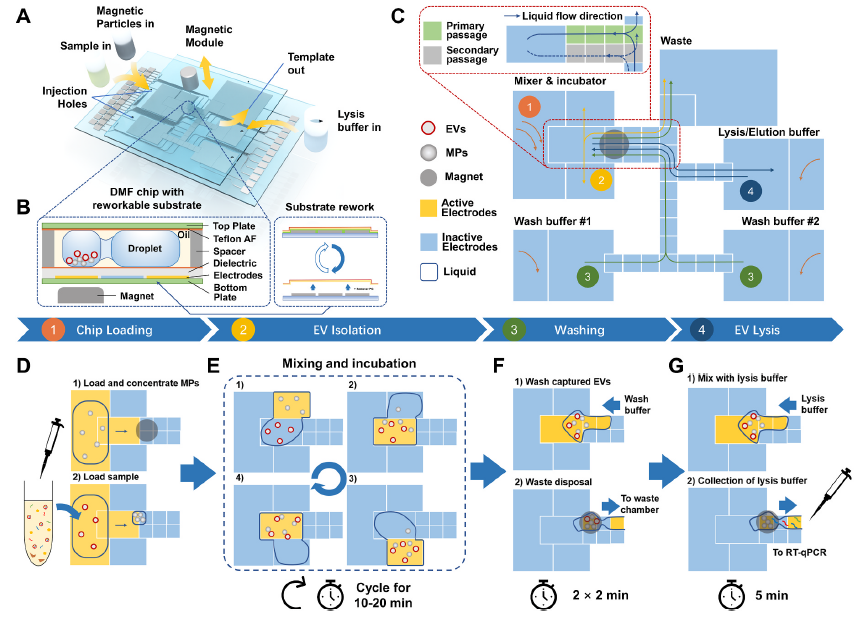
从体液中高效分离和富集细胞外囊泡是利用其进行无创或微创早期疾病诊断的重要前提。然而,细胞外囊泡小尺寸、异质性等特点使传统的分离方法受限。微流控技术由于具有样品和试剂消耗少、反应速度快、流体控制精确、潜在成本低等优势,在细胞外囊泡分离与即时检测中具有广泛应用前景。然而,尽管现有基于微流控的细胞外囊泡分离富集方法在回收率、纯度、速率等方面取得了一定进展,在处理流程的自动化程度以及处理时间方面仍然存在改进空间。近日,中国科学院上海微系统与信息技术研究所毛红菊研究员团队与上海交通大学医学院陈福祥教授以及复旦大学附属中山医院杨达伟副主任医师合作在Analytica Chimica Acta杂志上发表了题为“Rapid automated extracellular vesicle isolation and miRNA preparation on a cost-effective digital microfluidic platform” (1296 (2024) 342337)的研究。该工作研发了一种基于数字微流控(Digital Microfluidics, DMF)技术的细胞外囊泡来源miRNA预处理平台,可实现快速、自动从体液样本中分离纯化细胞外囊泡及其内容物miRNA,以供后续核酸检测与疾病辅助诊断的目的。
迄今为止,基于微流控技术的细胞外囊泡分离策略包括基于免疫亲和力捕获和基于尺寸分离的方法(如膜过滤法、芯片上微结构、外加声场、电场和利用粘弹性流特性)。然而,这些基于管道的微流控系统通常需要预先进行复杂的调试与校准,依赖于体积较大的外围控制系统,并且执行模式受到芯片及系统设计的限制,从而约束了它们向建立自动化和标准化流程的扩展。相对之下,数字微流控(DMF)技术是一种基于介电润湿(Electrowetting-on-dielectric, EWOD)效应的微量液滴操控技术,使用阵列化电极作为执行器,通过施加电压改变疏水表面上的局部润湿性,因而能够主动控制二维表面上的单个液滴并实现任意位移,适用于大规模自动化。此外,DMF的灵活性和可编程性使其能够执行复杂的样品处理程序,以实现即时检测情景下复杂样品的预处理步骤。因此,研究团队在自主建立的数字微流控平台上开发了一套适用于细胞外囊泡快速分离富集,以及核酸收集的方法流程。相比现有其他方法,该方法具有自动及处理时间短的特点,经过验证,可在20分钟内实现77%的细胞外囊泡捕获效率,并且处理流程中不需要人工干预,对于在即时诊断场景中的应用具有积极意义。以非小细胞肺癌(NSCLC)相关的细胞外囊泡miRNA检测为例,研究团队利用该方法进行了来自23名临床患者及20名未患癌志愿者血浆细胞外囊泡的预处理操作,通过后续qPCR检测得出miR-486-5p与miR-21-5p表达量与患NSCLC正相关的结论,与同步测试的商用化外泌体提取试剂盒得出的结果具有一致性。以上结论证明了DMF技术在细胞外囊泡相关研究领域的技术可行性以及潜在应用价值。Rapid automated extracellular vesicle isolation and miRNA preparation on a cost-effective digital microfluidic platform, Anal Chim Acta. 2024 Apr 1:1296:342337. doi: 10.1016/j.aca.2024.342337.
外泌体资讯网 Analytica Chimica Acta | 一种能够快速自动分离细胞外小泡和制备miRNA的数字微流体平台