外泌体作为一种有前景的纳米载体药物递送技术,持续引起人们的关注。它们是天然来源的纳米级细胞外囊泡,具有天然的属性,非常适合在细胞之间传递蛋白质、脂质和核酸。然而,由于它们无法靶向肿瘤细胞,以及肝脏和脾脏的单核吞噬细胞系统(MPS)清除的比例高,它们的临床应用目前受到了几个主要挑战的限制。为了克服这些限制,来自美国托莱多大学的SHI-HE LIU教授在J Control Release杂志发表文章,报道了通过CD9工程化共显示RGD和CD47p110-130的“智能外泌体”(ExoSmart),用于胰腺导管腺癌的治疗应用研究。
胰腺导管腺癌(PDAC)是最致命的癌症之一,在美国的癌症相关死亡中排名第四。PDAC的整体5年生存率估计为11%,而对于可切除的PDAC患者,5年生存率为20-25%。目前用于辅助治疗的药物递送系统难以有效地将治疗药物运送到肿瘤细胞中。
纳米载体输送系统的最新进展前景广阔,但在这些系统能够应用于临床领域之前,还需要克服一些挑战。在我们看来,主要的挑战包括(1)积极的细胞靶向和(2)避免被网状内皮系统(RES)或单核吞噬细胞系统(MPS)迅速清除。基于外泌体的纳米载体输送系统独特地适用于解决这些挑战。
外泌体是一种天然来源的、纳米尺度的、脂质双层包裹的细胞外囊泡,由大多数真核细胞产生。外泌体是有用的纳米载体,因为它们的小尺寸使其能够深入组织并有效地穿越物理和生物屏障(例如,血脑屏障)。此外,外泌体具有微弱的ζ电位,有助于维持其循环时间。它们的固有生物相容性和可变形结构是其额外的优势。例如,它们的可变形结构可能独特地使其能够进行纳米级的渗出,包括趋化、出血和穿越细胞外基质,以在组织微环境中深入传递分子信号。由于这些优点,外泌体已被用于体外和体内递送多种治疗药物,并将紫杉醇(PTX)对耐药癌细胞的治疗效果提高了多达50倍。
已经进行了许多尝试,通过将编码特定靶向蛋白的基因插入外泌体供体细胞,以更有效地使外泌体靶向癌细胞。以前有效展示肽配体的努力依赖于溶酶体相关膜蛋白2B(LAMP2B)、血小板源性生长因子受体(PDGFR)和乳酸蛋白的C1C2域。这些策略的局限性包括LAMP2B融合的N端的蛋白质降解,PDGFR的不可靠的外泌体标记和C1C2的未成功的膜融合。为此,本研究展示了几种有效的基于外泌体的药物递送的替代策略。具体来说,我们展示了(1)基于CD9的策略,改善外泌体表面的肽配体展示,(2)基于RGD的策略,改善外泌体的靶向能力,以及(3)基于CD47的策略,改善外泌体逃避免疫清除。
CD9,是四跨膜蛋白家族的一个21-24 kDa成员,富集在外泌体膜上,常被用作外泌体生物标志物。以前对CD9 N-端的工程化努力促进了货物蛋白质成功装载到新生成的外泌体中;然而,如何或是否将肽插入CD9的细胞外域仍然未知。
整合素αvβ3在包括胰腺导管腺癌(PDAC)在内的各种癌症中广泛表达,并与癌细胞的生长、存活、侵袭和转移有关。RGD肽是αvβ3的配体;两者都已经被深入研究用于癌症靶向治疗和抗血管生成。RGD不仅促进纳米颗粒被癌细胞摄取——这表明了它在靶向递送系统中的强大作用——而且还作为整合素拮抗剂,阻断细胞外基质和癌细胞之间的相互作用,破坏促肿瘤信号通路。
在药物递送中使用外泌体的最早被认识到的障碍之一是它们在体内给药后从循环中迅速清除。荧光素酶表达的外泌体在小鼠静脉注射后迅速从血液中消失(半衰期为2分钟)。还有几项研究也证明,外泌体在静脉注射后会迅速被肝脏、脾脏和肺部清除。巨噬细胞的吞噬作用已被确定为外泌体内化的主要机制。解决这个问题的一个可能的方案可能是在外泌体表面添加CD47。CD47已被证明可以作为对巨噬细胞的“不要吃我”的信号,这有助于CD47呈现的细胞逃避吞噬并最小化MPS清除。尽管认为间充质干细胞(MSC)来源的外泌体是药物递送的优秀纳米载体,但MSC外泌体上的CD47表达相对较低,不足以保护这些外泌体免受巨噬细胞的吞噬。人们认为CD47p110-130在介导CD47与SIRPα的相互作用中起着关键作用,这是其逃避吞噬和MPS清除的能力的基础。然而,目前还不清楚CD47p110-130是否可以在外泌体上显示。
这项研究的假设是,通过CD9工程技术在外泌体上展示肿瘤寻找肽和CD47p110–130,将允许外泌体在体内主动针对胰腺导管腺癌(PDAC),同时允许它们逃避单核吞噬细胞系统(MPS)的清除。为了测试这个假设,开发了新的RGD和CD47p110–130展示的智能外泌体(ExoSmart),它们显示出对PDAC细胞上的αvβ3的增强的结合能力,导致体外和体内模型中的细胞摄取增加,以及化疗效果的提高。同时,ExoSmart显著减少了通过CD47p110–130与巨噬细胞上的SIRPα相互作用抑制巨噬细胞吞噬,从而减少了肝脏和脾脏对外泌体的清除。这些研究表明,一个工程化的外泌体药物输送系统通过增强对PDAC的主动靶向和延长循环时间,提高了PDAC的治疗效果。
研究结果表明,ExoSmart对胰腺导管腺癌(PDAC)细胞上的αvβ3具有增强的结合能力,导致体外和体内模型中的细胞摄取增强,以及化疗效果的提高。同时,ExoSmart通过抑制巨噬细胞的吞噬作用,显著减少了肝脏和脾脏对外泌体的清除,这是通过CD47p110-130与巨噬细胞上的信号调节蛋白(SIRPα)的相互作用实现的。这些研究表明,工程化的外泌体药物递送系统通过增强对PDAC的主动靶向和延长循环时间,提高了PDAC的治疗效果,该发现为癌症治疗提供了巨大的转化潜力,同时为未来利用新型肽工程化外泌体策略的工作提供了坚实的基础。
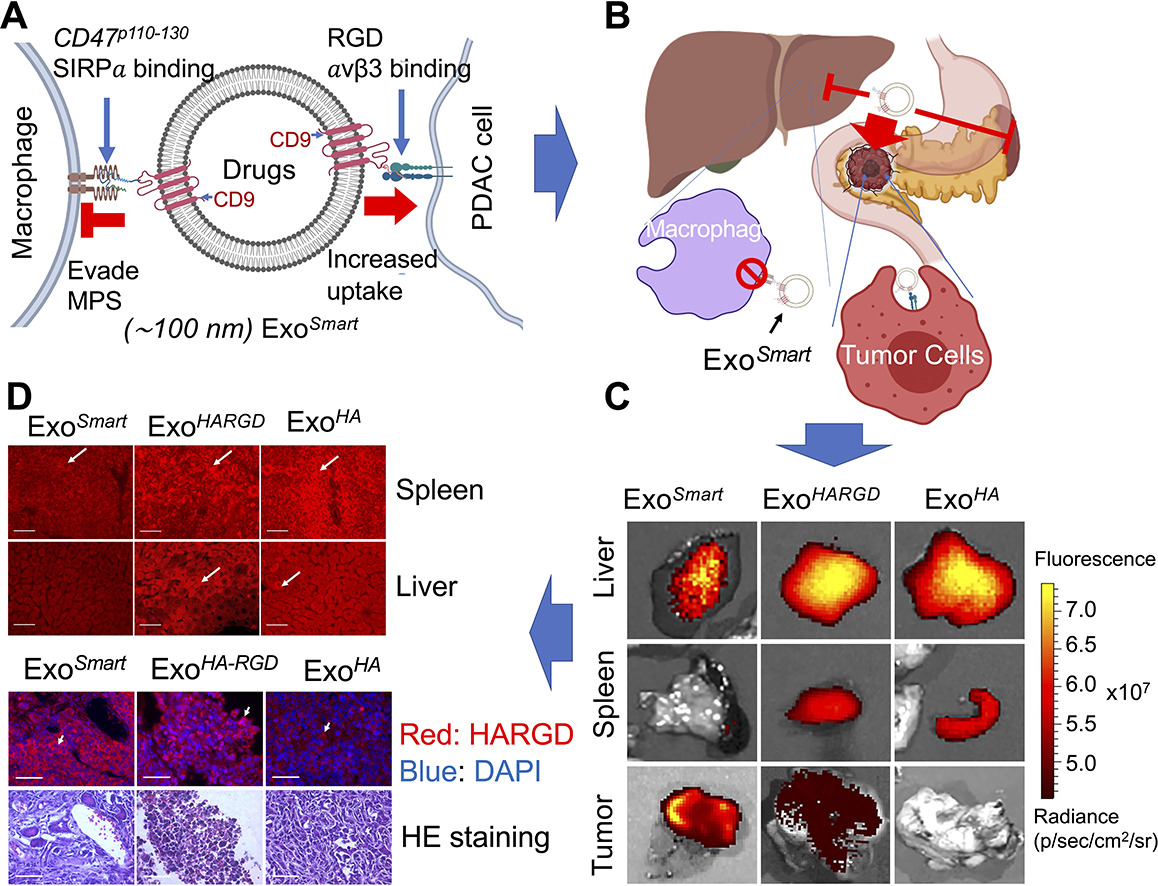 ExoSmart增强了胰腺癌(PDAC)的靶向性,同时增加了对单核吞噬系统(MPS)清除的逃避。 (A) ExoSmart的图示; (B) ExoSmart工作模型的示意图; (C) 通过静脉注射接收DiR染色外泌体的PDAC原位小鼠的肝脏、脾脏和肿瘤的荧光成像; (D) 使用抗血凝素(HA)抗体对肝脏、脾脏和肿瘤中的外泌体进行免疫荧光分析。
ExoSmart增强了胰腺癌(PDAC)的靶向性,同时增加了对单核吞噬系统(MPS)清除的逃避。 (A) ExoSmart的图示; (B) ExoSmart工作模型的示意图; (C) 通过静脉注射接收DiR染色外泌体的PDAC原位小鼠的肝脏、脾脏和肿瘤的荧光成像; (D) 使用抗血凝素(HA)抗体对肝脏、脾脏和肿瘤中的外泌体进行免疫荧光分析。
参考文献:
Creeden JF, Sevier J, Zhang JT, Lapitsky Y, Brunicardi FC, Jin G, Nemunaitis J, Liu JY, Kalinoski A, Rao D, Liu SH. Smart exosomes enhance PDAC targeted therapy. J Control Release. 2024 Mar 6;368:413-429. doi: 10.1016/j.jconrel.2024.02.037. PMID: 38431093.





