皮肤替代物如表皮重构模型已经被开发用于各种应用,包括伤口愈合和皮肤再生。这些细胞模型大多来源于原代细胞,如角质细胞和成纤维细胞,处于二维(2D)状态,因此需要进一步发展三维(3D)培养的器官结构,以提供对体内表皮表型和生理的深入了解。
来自韩国生物科学与生物技术研究所的研究人员建立了从诱导多能干细胞(iPSCs)分化出释放功能性EVs的表皮器官结构(EpiOs),这些iPSC源的表皮器官结构(iEpiOs)由基底表皮细胞层和包括棘层、颗粒层和角质层在内的分化表皮细胞层组成,与体内表皮形态非常相似。他们发现,三维培养的iEpiOs能够产生功能性EVs,其中包含具有增强再生能力和有助于未来治疗发展的生物分子。该研究提供了一种来源于PSCs的可扩展和功能性的表皮器官结构,有希望用于生物治疗。相关内容以“Development of pluripotent stem cell-derived epidermal organoids that generate effective extracellular vesicles in skin regeneration”为题在线发表于2月23日的国际知名材料学领域学术期刊Biomaterials上。
人的皮肤表皮具有防止水分丢失、物理损伤和化学损伤的屏障功能。由于表皮干细胞位于其基底层并自我增殖或向外分化形成角化层皮肤屏障,因此具有很高的再生能力。之前关于原代角质细胞或从诱导多能干细胞(iPSCs)分化而来的角质细胞的研究主要使用二维(2D)培养来研究与肿瘤发生、炎症和屏障功能相关的表皮干细胞生物学。然而,尽管原代细胞处理具有许多优点,但二维培养的原代表皮细胞存在局限性,包括在体外维持受限、难以复制人体表皮的细胞组成和生理结构以及与不同供体的重复性不同。角质细胞还可以通过转移式空气液相(ALI)培养重构成功能性的人体表皮模拟物,模拟人体皮肤生理学。然而,这种重构的三维(3D)表皮模拟物也存在难以维持的障碍,因此需要一个易于扩展的模型。
为了克服这些困难,已经开发了器官结构模型,用于培养成年小鼠和人类表皮细胞并将其终末分化成表皮细胞层。此外,已经有研究人员从多能干细胞(PSCs)中开发出由表皮、真皮、皮脂腺、神经元和功能性毛囊组成的小鼠和人类皮肤组织,促进了对皮肤发育和疾病的进一步研究。然而,直接从PSCs发展出可以在体外稳定培养的表皮器官结构尚未报告。
随着组织工程学的最新发展,通过器官结构的发展,尝试了包含各种细胞类型的体外三维培养器官结构模型,以克服二维原代细胞培养的缺点。三维培养的器官结构系统具有许多优点:(i)它保持体内表型和功能,(ii)长期增殖,(iii)自组装并重现体内结构。此外,三维培养的器官结构源自多能或组织干细胞,并且可以自我组织成类似生理上相关的体内结构的多细胞结构,而三维培养的细胞(如球体)涉及直接封装或聚集细胞,无法复制器官中复杂的多细胞协作。因此,有必要开发模拟体内组织并将其用作生物材料的器官结构模型,包括它们本身以及它们的副产品,如反映其多细胞起源的细胞外囊泡(EVs)。
EVs是一种异质性的、与脂质结合的囊泡,释放到细胞微环境中。EVs转移多种分子货物,如核酸(包括mRNA、microRNA(miRNA)、长链非编码RNA(lncRNA)、其他小RNA物种和DNA碎片)、脂质(包括磷脂和胆固醇)和代谢产物。EVs还携带蛋白质,如表面蛋白质(包括整合素、跨膜蛋白CD9、CD63和CD81、粘附分子)以及细胞质蛋白(例如Tsg101和Alix)。这些货物取决于EVs的生物发生和产生EVs的细胞类型。EV载荷的组成有助于它们在生理和病理过程中的多种作用。鉴于EVs在细胞间通讯中的作用,EVs具有治疗潜力,因为它们通过其旁分泌作用参与各种生理过程。例如,与单独使用间充质基质细胞(MSCs)相比,来源于MSCs的小型EVs在多个疾病模型中显示出更强大的治疗活性。
最近,三维培养系统已成为分泌EVs以增强其功能性和治疗效果的有前途的模型。三维基质支架法使用外源材料如水凝胶提供细胞-细胞外基质(ECM)和细胞-细胞相互作用,而无支架的三维培养方法如球体模拟细胞-细胞通讯而不附着于支架。此外,三维培养方法可用于增加EV产量;例如,MSCs的三维球体培养增强了总EV产量,同时保持了在二维培养中预期的典型MSC-EV特性。此外,反映要模拟的器官结构的三维器官结构通常通过将干细胞嵌入ECM(如Matrigel)来开发,从而支持分化和细胞粘附,并因此具有提供三维培养方法优势的潜力。尽管已经报道了来自多细胞器官结构的EVs的生产和作用,例如视网膜、肠道和脑器官结构,但其他基于器官结构的三维培养系统仍有待探索。
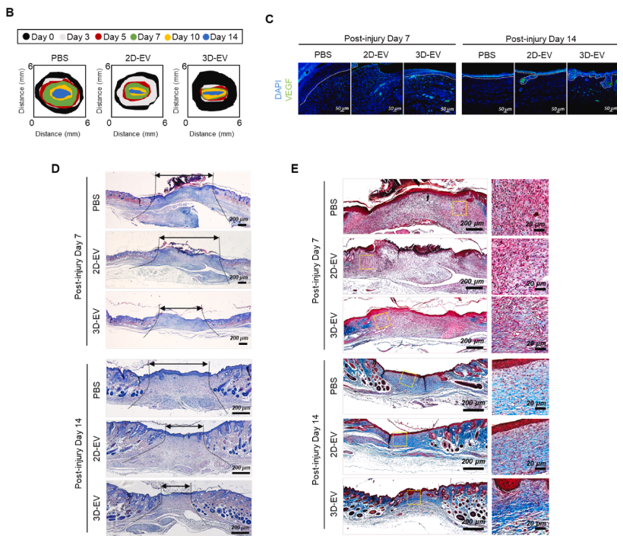
在这项研究中,研究人员从诱导多能干细胞(iPSCs)生成的表皮器官结构(EpiOs)作为一种新型表皮构建物,并将其作为细胞外囊泡(EVs)分泌生物分子的应用,这些分子可以用于无细胞的再生医学治疗。分化的iPSC衍生表皮器官结构(iEpiOs)易于培养和扩展成多个器官结构的通道,同时保留分子和功能特征,类似于体内表皮。这些成熟的iEpiOs包含表皮干细胞群体,并保留进一步分化为其他皮肤区域谱系,如毛囊干细胞的能力。RNA测序结果也揭示了维持iEpiO特性和发展分化表皮层的机制。通过模拟表皮结构,iEpiOs有望提供更相关的微环境,影响细胞过程和治疗反应。
重要的是,iEpiOs可以生成高性能的EVs,含有高水平的血管生成生长因子VEGF和miRNAs,预测调节细胞过程,如增殖、迁移、分化和血管生成。这些EVs促进了靶细胞的增殖、迁移和血管生成,为体内伤口愈合提供了一种有希望的治疗工具。总的来说,作为一种基于器官结构的方法,新开发的iEpiOs策略为研究基础和转化皮肤研究提供了一个强大的模型,并且可能也会导致使用iEpiOs分泌的EVs的未来治疗应用。
参考文献:Development of pluripotent stem cell-derived epidermal organoids that generate effective extracellular vesicles in skin regeneration. Biomaterials. 2024 Feb 23;307:122522.