本周囊泡相关的文章挺多的,但是高质量的依旧稀少,hzangs在最新文献中选取了5篇分享给大家,其中4篇提供了中文摘要。这周的内容主要涉及外泌体与肿瘤恶性维持、外泌体与肿瘤诊断治疗、外泌体与急性胰腺炎等。相关文章的原文都在论坛同名贴下,需要的可以到论坛下载。值得关注的是JEV最新的paper,该review paper总结了不同外泌体分离方法的优劣,新接触外泌体领域的朋友可以了解一下。
1. Exosomal miRNAs as cancer biomarkers and therapeutic targets.外泌体miRNA作为肿瘤标志物及治疗靶点。 [J Extracell Vesicles] IF=? PMID:27440105
摘要:癌细胞之间以及癌细胞与微环境和远端环境的信息通讯对癌细胞存活、恶性加深和转移至关重要。外泌体在这个通讯过程中发挥着作用。癌细胞内microRNA(miRNA)的表达经常出现异常,而通过从癌症病人的体液中分离外泌体miRNA可以检测这种异常。本文中,我们对exosomes miRNA作为诊断标志物和治疗靶点进行了深入的探讨。外泌体是体液中miRNA的可靠来源,尽管目前有许多种外泌体分离以及外泌体miRNA定量的方法,但它们是否适用于临床诊断目前依旧是值得怀疑的。此外,有研究表明外泌体携带的miRNA可以改变受体肿瘤细胞或受体基质细胞的行为从而促进癌症的进程,这些结果凸显了外泌体在癌症中介导细胞间通信的重要作用。然而,目前我们并不完全了解外泌体的形成及miRNA装载进入外泌体的机制,这就意味着我们目前靶向外泌体或外泌体中miRNA并不具有肿瘤细胞特异性。因此,如果将外泌体miRNA作为非侵入性诊断标志物或肿瘤治疗靶点,那么两方面的问题亟待解决:优化外泌体miRNA的提取和检测手段,进一步深入了解外泌体miRNA的产生及在肿瘤细胞通讯中的作用机制。
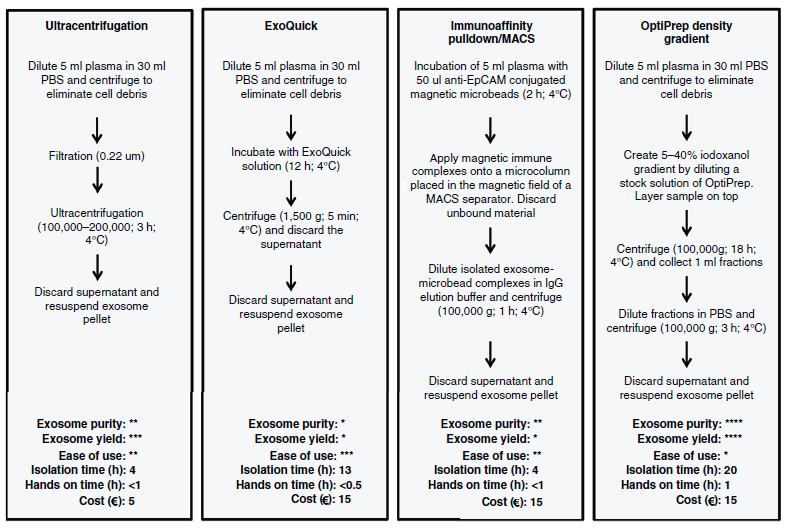
PS:到目前JEV都没有影响因子,估计今年也未必会出来,毕竟一年刊发的文章不过那么几篇,要出IF可能还需要再等等。言归正传,JEV本周发表的外泌体miRNA目前在肿瘤标志物和治疗靶点方面的综述性文章,文章对目前外泌体的分离方法、外泌体miRNA检测手段,治疗靶点进行了汇总同时指出了目前存在的问题。文章讨论了目前实验室常用分离方法并做了一个简要图表对比。文章认为目前梯度密度离心纯度和产量最高而ExoQuick最低,但ExoQuick这一类的方法是目前最为简便易操作的方法(见下图)。
2. Microvesicle Cargo and Function Changes Upon the Induction of Cellular Transformation.细胞癌化前后微囊泡内含物和功能的变化。 [J Biol Chem] IF=4.258。 PMID: 27440046
摘要:细胞外囊泡(EVs)主要包括外泌体和微囊泡,研究显示这些囊泡在包括癌细胞在内的细胞间通信中发挥着重要作用。癌细胞释放的囊泡包涵很多种蛋白和RNA,它们可以在癌细胞间和癌细胞-正常细胞间传递从而影响癌症的各种进程。本文中我们使用了一株可诱导Dbl癌基因表达的小鼠胚胎成纤维细胞系(MEF)来研究癌化过程对EVs形成及功能的影响。我们发现,癌化对EVs的释放量并无明显影响,但Dbl癌化的细胞释放的MVs相比非癌化细胞会携带非受体型酪氨酸激酶——粘着斑激酶(FAK)。将癌化MEF产生的MVs加入到正常成纤维细胞中可以强烈的促进这些正常成纤维细胞的存活并赋予它们非贴壁依赖性生长的能力。敲低FAK、从MVs中去除FAK或者利用特异性抑制剂抑制FAK的活性,能够去除MVs的上述作用。我们在MDA-MB-231细胞中看到了类似现象。综合这些结果表明,细胞癌化后可以通过释放含有特定激酶的MVs来维持和传播癌化状态,这也为我们提供了一个潜在的诊断恶性肿瘤的标志物。
PS:肿瘤细胞分泌的囊泡对微环境的影响报道十分常见,而肿瘤细胞分泌的囊泡对肿瘤恶性性状的维持却研究很少,该文章通过一个体外模型发现了癌化细胞释放的囊泡与癌化前的差异,同时发现癌化细胞释放的囊泡在肿瘤恶性性状维持和传播中的作用,给予了我们对囊泡新的认识。但是的不足在于,其实用的是一个诱导癌化的体外模型,与体内真实的癌化过程存在差异,可能并不足以反应体内真实情况。文章发表在JBC上,数据相对比较夯实。
3. Involvement of exosomes in lung inflammation associated with experimental acute pancreatitis.外泌体参与了急性胰腺炎实验模型中肺炎症的发生。 [J Pathol] IF=7.381 PMID:27447723
摘要:急性胰腺炎常伴随有肺部损伤及系统性炎症反应。尽管研究人员发现在局部和全身各种各样的促炎因子参与了这些过程,但这一病理反应的机制依旧不是很清楚。外泌体会传递包裹的蛋白和RNA并防止这些蛋白和RNA降解。我们利用牛磺胆酸诱导的急性胰腺炎大鼠模型研究了外泌体在系统性炎症反应中的作用。我们发现急性胰腺炎会增加循环系统中的外泌体量,同时改变外泌体中的蛋白成分。使用PKH26标记的外泌体示踪显示外泌体很容易到达肺泡隔并被巨噬细胞吞噬。体外实验表明,炎症条件下产生的外泌体会促进肺泡巨噬细胞的激活和极化,使后者呈现促炎表型。通过蛋白质组学分析发现,这些循环系统中的外泌体来自多个器官,其中以肝脏来源的外泌体最为显著。同时,示踪试验也表明肝脏吸收了来自腹膜腔的大量外泌体。我们认为,外泌体参与了急性胰腺炎肺损伤,并且参与了全身炎症的发生。
PS:与炎症相关的外泌体研究,文章研究了急性胰腺炎肺损伤过程中外泌体作用,感兴趣可以读一读。
4. Biomaterials: Multifunctional Transmembrane Protein Ligands for Cell-Specific Targeting of Plasma Membrane-Derived Vesicles . 多功能跨膜蛋白配体赋予细胞膜来源的囊泡靶向特定细胞的能力。 [Small] PMID: 27439733
PS:在6月17日的周总结推荐过这篇文章,这篇文章主要是设计了一种穿膜蛋白配体提高囊泡的靶向性,在之前的推送中我们曾经介绍过这篇文章,感兴趣可以读一读 (PMID:27294846)(摘要译文:脂质体和纳米粒子结合细胞表面特定的受体可以靶向特定的细胞亚群。然而,化学合成配体连接到这些粒子上却很难控制,连接效率制约了配体的均一性和复杂性。相比之下,活细胞表面却具有多种均一的复杂跨膜蛋白修饰,本文中利用这一性质。我们证明了可以利用供体细胞使其质膜来源的微囊泡携带工程改造的跨膜蛋白配体精确靶向具有特定受体的细胞。这种多功能的工程改造蛋白配体包含一个配体结构域、一个使配体容易被结合的松散连接区和一个用于定量配体在微囊泡表面密度的荧光蛋白结构域。实验显示,携带EGFR亲和配体的囊泡会在EGFR高表达乳腺癌细胞处富集。此外,使用GFP单域抗体作为配体结构域的微囊泡会靶向表达EGFP融合受体的靶细胞。这表明该工程改造的配体有发展药物靶向递送系统的潜力。)。
5. Real time and label free profiling of clinically relevant exosomes.非标记性实时分析临床样本中的外泌体。 [Sci Rep] IF=5.228 PMID:27464736
PS:介绍实时分析临床样本中外泌体的方法,主要用于诊断,相关研究的朋友可以关注一下。
今天的整理就到这里。希望大家可以有所收获。大家下周见!
版权归外泌体之家所有,欢迎转载,但请注明出处和原文链接!
原文下载和讨论请点击:http://www.exosome.com.cn/forum.php?mod=viewthread&tid=1010