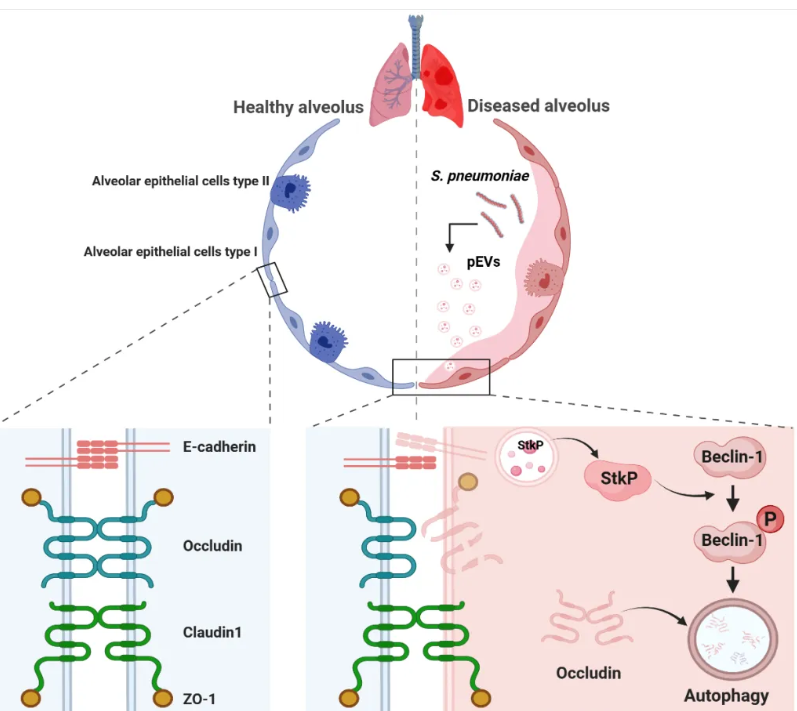
肺炎链球菌 (Streptococcus pneumoniae) 是一种常见的人类机会性致病菌,可引起轻微鼻窦炎,也可能导致严重的肺炎、菌血症和脑膜炎,每年全球有数百万人死于肺炎链球菌感染。胞外囊泡 (EVs) 是细菌分泌途径之一,在运输细菌蛋白、代谢物和核酸等物质方面发挥着重要作用,并在微生物与宿主互作、微生物之间相互作用以及抗生素耐药性获取方面具有关键意义。近日,华中农业大学动物科技学院、动物医学院王湘如教授团队在国际权威期刊Autophagy(2022 IF:13.3)上发表题为“Streptococcus pneumoniaeextracellular vesicles aggravate alveolar epithelial barrier disruption via autophagic degradation of OCLN (occludin)”的研究论文(doi: 10.1080/15548627.2024.2330043)。该研究发现在肺炎链球菌感染过程中,其胞外囊泡 (pEVs) 作为一种重要的运载工具,可递送细菌蛋白StkP至宿主细胞,通过劫持细胞自噬途径降解肺泡上皮细胞间紧密连接蛋白Occludin,导致肺泡上皮屏障功能的破坏。
自噬是依赖于溶酶体的一种胞内降解途径,在细菌感染过程中起着“双刃剑”的作用。一方面,细菌感染激活的宿主细胞自噬可以作为一种保护性的免疫反应促进胞内细菌的清除。另一方面,细菌也可以劫持宿主细胞的自噬途径,促进自身在宿主细胞内的存活。该研究从自噬着手,聚焦细菌-细胞之间的相互作用,对肺炎链球菌感染引起的肺泡上皮屏障损伤的机制进行了探索。研究首先通过动物感染试验、体外上皮屏障功能分析、电镜观察、激光共聚焦等一系列实验,证实肺炎链球菌感染可以在体内外引起肺泡上皮细胞的自噬激活以及肺泡上皮屏障的破坏。通过进一步自噬阻断、TurboID邻近蛋白标记、免疫沉淀等方法,发现肺炎链球菌感染造成了肺泡上皮细胞系 (A549细胞) 中Occludin蛋白的自噬降解,从而加剧肺泡上皮屏障的功能损伤。为了进一步探索其机制,该研究通过4D Label-free蛋白组学分析发现肺炎链球菌的pEVs中包括一些经典的细菌毒力因子以及酶类。作者关注到了其中的StkP蛋白,该蛋白作为一种真核样丝氨酸-苏氨酸激酶 (eSTKs),与真核生物中的蛋白激酶具有相似的结构和功能,参与多种生物学过程。通过细胞毒性检测、Western blot、免疫共沉淀、激光共聚焦以及磷酸化位点突变等研究,作者发现StkP蛋白作为pEVs的“货物”蛋白,可随着pEVs进入宿主细胞内部,并与宿主自噬起始蛋白Beclin1发生相互作用诱导其磷酸化,进而激活自噬通路,导致Occludin蛋白的自噬降解及肺泡上皮屏障的损伤。同时,构建肺炎链球菌D39的stkP基因缺失株 (D39-ΔstkP)用于小鼠感染试验,发现stkP的缺失突变显著降低了肺炎链球菌对小鼠的致死性及对肺组织的损伤,且D39-ΔstkP来源的pEVs对A549细胞的自噬激活及细胞屏障破坏作用也显著减弱。总之,这项研究揭示了一种肺炎链球菌pEVs来源的StkP蛋白与宿主细胞互作的新方式,即细菌通过pEVs的方式递送StkP蛋白靶向宿主的自噬通路,引起肺泡上皮细胞间连接蛋白Occludin的自噬降解及屏障功能受损,进而增加了细菌的致病性。该研究为肺炎链球菌感染入侵的有效预防及治疗提供了新的思路。肺炎链球菌通过胞外囊泡递送StkP破坏肺泡上皮屏障的机制示意图华中农业大学动物科技学院、动物医学院博士研究生崔潞晴为论文第一作者,王湘如教授为该论文的通讯作者,团队负责人陈焕春院士在研究过程中给予了大量指导建议,杨瑞成副研究员、李亮博士后、研究生霍栋、屈馨怡、王珺丹、王心怡和刘虎林共同参与了此项研究。该研究得到国家重点研发计划(2021YFD1800405)、国家自然科学基金(32122086)以及中央高校基本科研业务费专项资金(2662023PY005)等项目的大力资助。Streptococcus pneumoniae extracellular vesicles aggravate alveolar epithelial barrier disruption via autophagic degradation of OCLN (occludin). Autophagy. 2024 Mar 18. doi: 10.1080/15548627.2024.2330043.外泌体资讯网 Autophagy | 华中农业大学王湘如教授团队:肺炎链球菌细胞外小泡通过诱导occludin蛋白自噬降解加重肺泡上皮屏障破坏